

A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
| Influenza | |
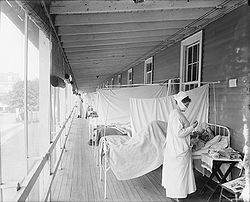 | |
| Amerikai kórház a spanyolnátha idején | |
| Szinonimák | grippe |
| Latinul | influentia, grippa, febris catarrhalis epidemica |
| Angolul | influenza, flu |
| BNO-10 | |
| BNO-9 | 487 |
| Leírás | |
| Érintett szervek | légutak, tüdő, szív |
| Etiológia | vírusfertőzés, cseppfertőzés útján |
| Kockázati tényezők | járvány |
| Főbb tünetek | láz, izomfájdalom, elesettség, száraz köhögés |
| Szövődmények | tüdőgyulladás, szívizomgyulladás |
| Kezelés | tüneti kezelés, antivirális gyógyszerek |
| Megelőzés | védőoltás, antivirális gyógyszerek |
| OMIM | 614680 |
| DiseasesDB | 6791 |
| MedlinePlus | 000080 |
A Wikimédia Commons tartalmaz Influenza témájú médiaállományokat. | |
Az influenza (grippe) egy vírus által okozott fertőző betegség.[1] A kórokozó influenzavírusok emlősöket és madarakat képesek megfertőzni. A betegség az emberek között cseppfertőzés útján[1] (kis távolságra[2]), közvetlen testi érintkezéssel vagy a beteg által megérintett tárgyakkal terjed,[3][2][4] ezért a fertőzés megelőzésében a mindennapi higiénia szerepe megkerülhetetlen. Fő tünetei a hirtelen kezdődő láz, orrfolyás, torokfájás, izomfájdalom, fejfájás, fáradtság, elesettség, később pedig száraz köhögés.[1] Különösen időseknél léphetnek fel súlyos szövődmények: tüdőgyulladás, a homloküreg gyulladása, asztma, szívműködési zavarok.[3]
A tünetek különböző súlyosságúak lehetnek.[3] A kétnapos lappangási idő után számított egy héten belül a legtöbb tünet megszűnik, de a köhögés két hétig is kitart. Gyerekekben előfordulhat hasmenés és hányás, de felnőtteknél ezek ritkák. Ezek felülfertőzéstől alakulnak ki.[5]
Az influenzavírusok négy típusa közül az A, a B és a C fertőz embereket.[6][7] Ez a D típus esetén még nem ismert, de feltehetően képes lenne rá.[7][8] A beteg a lappangási időszak kezdetétől egészen a tünetek elmúlásáig fertőz.[3] A teszteléshez köpetből, torokból, illetve orrból vesznek mintát.[6] Számos gyorsteszt érhető el, ám a fertőzés nem biztos, hogy kimutatható. A vírus RNS-ét kimutató polimeráz láncreakció (PCR) megbízhatóbb.[6]
A vírus terjedését lassítja a gyakori kézmosás, és a maszk viselése.[9] A WHO a kockázati csoportok számára évenkénti oltást ajánl.[1] A Centers for Disease Control and Prevention (CDC) ajánlása féléves kortól szól.[10] Az oltás három vagy négy típus ellen véd, és csak ritkán okoz komolyabb problémát. A vírus gyors mutálódása miatt évenként új oltóanyagot kell készíteni.[1] Az antivirális szereket kipróbálták,[1] de nem segítették a gyógyulást se csak máskülönben egészséges,[11] se egyébként is beteg fertőzötteknél.[11][12]
Minden évben megindul az influenza. Évente világszerte 3-5 millió esetben okoz súlyos betegséget, és 290 000-650 000 beteg bele is hal.[1][13] Az oltatlan gyerekek 20%-a, az oltatlan felnőttek 10%-a megfertőződik.[14] A mérsékelt és a hideg égövben jellemzően a téli időszakban jelentkezik; a trópusokon is előfordul, ott egész évben.[1] A legtöbb halott kisgyerek, idős, vagy krónikus beteg.[1] Ritkán okoz pandémiát;[6] a 20. században három influenzapandémia ismeretes: a spanyolinfluenza 1918-ban (17-100 millió halál); az ázsiai influenza 1957-ben (kétmillió halál); és a hongkongi influenza 1968-ban (egymillió halál).[15][16][17] A WHO 2009-ben az új influenza A/H1N1 terjedését pandémiává nyilvánította.[18] Nemcsak az emberre veszélyes, hanem más fajokra is, mint disznókra, lovakra és madarakra.[19]
Kapcsolódó BNO-kódok (BNO-10)
- J1000 Influenza tüdőgyulladással, influenzavírus identifikált
- J1001 Influenza tüdőgyulladással, H1N1 influenzavírus identifikált
- J1010 Influenza egyéb légúti tünetekkel, influenzavírus identifikált
- J1011 Influenza egyéb légúti tünetekkel, H1N1 influenzavírus identifikált
- J1080 Influenza egyéb tünetekkel, influenzavírus identifikált
- J1081 Influenza egyéb tünetekkel, H1N1 influenzavírus identifikált
- J1100 Influenza tüdőgyulladással, vírus nem identifikált
- J1110 Influenza egyéb légúti tünetekkel, vírus nem identifikált
- J1180 Influenza egyéb tünetekkel, vírus nem identifikált
- Z2510 Influenza elleni immunizációra szoruló személy
Kórokozói


Az influenzát az ortomixovírusok (Orthomyxoviridae) családjába tartozó influenzavírus A, influenzavírus B és influenzavírus C okozzák.[20] Az influenzavírusok genomja nyolc szegmens negatív egyszálú RNS-ből áll.
A vírust lipidtartalmú burok (envelope) veszi körül. Ebből a burokból nyúlnak ki a neuraminidáz és a hemagglutinin glikoproteinek.
A gazdaszervezet immunrendszere a neuraminidáz (NA) és a hemagglutinin (HA) alapján tudja felismerni a kórokozót. E glikoproteineknek azonban több altípusuk is létezik: influenzavírus A hemagglutininjéből eddig 16 altípust (H1-H16), neuraminidázából pedig kilencet (N1-N9) írtak le.
A felszíni glikoproteinek antigenitása gyakran megváltozik (tehát az immunrendszer „többé nem ismeri fel”), s ez az alapja az influenzajárványoknak. E változásnak két módját ismerjük:
- Antigen drift: pontmutációk következtében a glikoproteinek egy-egy aminosava változik meg
- Antigen shift: akkor következhet be, ha egyazon sejtet többféle vírus is megfertőz. Ilyenkor genetikai rekombináció jön létre, tehát a két vírusgenom elegyéből új változatok alakulnak ki. A rekombináció alapja, hogy a vírusgenom több különálló RNS-szegmensből áll, melyek tehát könnyedén „összekeveredhetnek egymással”. Az antigen shift jelenségét csak az A típusú influenzavírusok esetében figyelték meg.
Az influenzavírus-törzsek jelölésére speciális kódot használnak, amely a vírus típusát (A, B, C) és HA/NA antigenitását (pl. H3N2) valamint a gazdaszervezetet (pl. disznó), a földrajzi eredetet és egy törzsszámot tartalmaz. Pl. A/Brisbane/10/2007 (H3N2), B/Florida/4/2006. Az influenza D típusát 2016-ban fedezték fel,[21][22][23][24][25][26][27] de kiderült, hogy már 2011-ben izolálták.[8]
Csak távolról rokonok a humán parainfluenza vírusokkal, melyek a paramyxovírus családba tartozó RNS-vírusok. Ezek szintén légúti betegséget okoznak, a kruppot, amelynek tünetei felnőtteknél az influenzához hasonlíthatnak.[28][29]
Influenzavírus A
Az A típusú influenzavírus az emberen kívül más emlősök és madarak között is elterjedt kórokozó. Természetes gazdái vad vízimadarak, ahol a vírusnak számos változata megtalálható. Ez okozza a legnagyobb (akár világméretű) járványokat és a legsúlyosabb betegségeket:antigen shift révén ugyanis gyakran alakulnak ki újabb változatok, melyek ellen a gazdaszervezetek még nem védettek. Az emberre a baromfiról ugrik rá.[30]
Jelenleg a legelterjedtebb emberi kórokozók a H1N1 és a H3N2 altípusú A-vírusok. Eddig a következőket találták meg emberben:
- H1N1, a spanyolnátha kórokozója 1918-ban, illetve a sertésinfluenza okozója, 2009-ben
- H2N2, az ázsiai influenza kórokozója, 1957-ben
- H3N2, ami a hongkongi influenzát okozta, 1968-ban
- H5N1, a 2004-es madárinfluenza vírusa[31][32]
- H7N7, szokatlan fertőzési potenciállal az állatok körében[33]
- H1N2, madarakban, emberben és sertésben is előfordul
- H9N2
- H7N2
- H7N3
- H10N7
- H7N9, amelyről 2018-ban úgy találták, hogy az A típusú influenzák közül ennek a legnagyobb a pandémiás potenciálja[34]
- H6N1, csak egy embernél találták meg, aki utána meggyógyult[35]
Influenzavírus B
A B típusú influenza ritkább, mint az A típus, és főként embereket fertőz.[36] Csak a vadászgörényről[37] és a fókákról[38] ismert még, hogy fogékonyak erre a vírusra. Mutációs rátája 2-3-sor lassabb, mint az A típusé,[39] így csak egy szerotípusa van.[36] A fertőzésen már korán átesnek az emberek, amely egy időre immunissá teszi őket.[40] Mindez elég arra, hogy ne okozhasson pandémiát.[41]
Influenzavírus C és D
A C típusú influenza leginkább gyermekközösségekben terjed, enyhe megbetegedést okozva.[42][43] Érinthet kutyákat és sertéseket is. Következménye néha komolyabb megbetegedés és helyi járványok.[44][45] Ritkább, mint az előző kettő.
A D típusú influenza sertések és szarvasmarhák között terjed. Eddig nem mutatták ki emberben, de megvan benne a potenciál az ember fertőzésére.[8]
Szerkezet, tulajdonságok és altípus nevezéktan

Az A, B, C és D vírusok szerkezete nagyon hasonló.[8][46][47] A vírusrészecske (virion) 80-120 nanométer átmérőjű, és a kisebbek ellipszoid alakúak. Hossza változó, vannak hosszú, fonalszerű virionok is, hosszuk akár a mikrométer tízszerese is lehet. Változatos formájuk dacára szerkezetük hasonló. Burkuk hemagglutinint és neuraminidázt tartalmaz, melyek egy központi magot vesznek körül. A mag az RNS-ből, illetve az azt védő és csomagoló fehérjékből áll. A legtöbb virionban az RNS egyszálú, de vannak kétszálú RNS-t tartalmazók is. Az RNS az eukarióták kromoszómáihoz hasonlóan szegmensekből áll, amelyek száma hét-nyolc. Ha az RNS egyszálú, akkor negatív értelmű. Egy szegmens egy-két fehérjét kódol.[48] Az influenza-A 11 fehérjéje: hemagglutinin (HA), neuraminidáz (NA), nukleoprotein (NP), M1 (mátrix 1 protein), M2, NS1 (nem szerkezeti protein 1), NS2 (más néven NEP, nukleáris export protein), PA, PB1 (polimerázbázis 1), PB1-F2 és PB2.[49]
A hemagglutinin (HA) és a neuraminidáz (NA) két nagy glikoprotein, melyek a vírus külső burkának részei. A hemagglutinin egy lektin, ami segít a vírusnak a célsejthez kapcsolódni és az örökítőanyagát bejuttatni, míg a neuraminidáz az új virionoknak segít a sejtből kijutni, kiszabadítva az őket borító cukormázból.[50] Ezért a gyógyszerek ezeket célozzák. Továbbá antigénként működnek, amelyek ellen antitestek termelődnek. Az influenza A osztályozását a hemagglutinin (HA) és a neuraminidáz alapján végzik. A szerotípusban H jelöli a hemagglutinint, és N a neuraminidázt.[51] A számok azt jelzik, hogy az adott fehérjét hányadikként írták le. 18 H és 11 N típust írtak le; ezek közül nem mindegyik kombináció fordul elő. Emberben a H 1, 2 és 3, illetve N 1 és 2 típusok gyakoriak.[52][53] Ezek kombinációjából áll össze a szerotípus, például H5N1.[51]
Lefolyása

Magyarországon a járványveszélyes időszak október elejétől április végéig tart.
A vírusoknak élő sejtre van szükségük a szaporodáshoz.[54] Az influenza szaporodása több lépésből áll: A fertőző váladék (pl. köhögéskor aeroszolként) bejut a gazdaszervezet légútjaiba. Először a vírusnak a sejthez kell kapcsolódnia, és bejuttatnia örökítőanyagát a sejtbe egy olyan helyre, ahol új másolatok készülhetnek róla és az általa kódolt fehérjékről. Ezekből az elemekből aztán a sejt összeállítja a vírusokat, majd az új vírusok elhagyják a sejtet, ami haláláig folytathatja a vírusok termelését.[48]
Az influenza vírusa a hemagglutininnel kapcsolódik az epithélium sejtjeinek felszínének szialinsav cukraihoz. Emlősökben a légutakban (orr, torok, tüdő), madarakban a belekben telepszik meg.[55] Miután egy proteáz lebontja a hemagglutinint, a vírus endocitózissal a sejtbe jut.[56]
A vírus sejten belüli működése nem ismert részletesen. Annyit tudunk, hogy a virionok a mikrotubulusok központját közelítik meg, kapcsolatba lépnek a savas endoszómákkal, végül belépnek a cél endoszómába a genom kiadására.[57]
Az endoszómában levő savas közeg hatására a hemagglutinin a vakuólum hártyához tapad. Ezután az M2 ioncsatorna protonokat enged át, ami savassá teszi a vírus magját.[48] A mag felbomlik, a vírus RNS-e és az azt támasztó fehérjék kiszabadulnak a sejtplazmába.[58] Az amantadin blokkolja az M2 ioncsatornát, ezzel megelőzve a fertőzést.[59]
A mag fehérjéi és a vRNS által alkotott komplex a sejtmagba transzportálódik, ahol az RNS-függő RNS-polimeráz megkezdi a szál átírását pozitív értelmű vRNS-sé.[60] A pozitív értelmű vRNS maradhat a magban, vagy kijuthat a sejt plazmájába. A fehérjék egy részét a Golgi-készülék kiteszi a sejthártyára, így a hemagglutininből és a neuraminidázból is jut oda. A többi termék visszajut a sejtmagba, ahol részt vesz az újabb vírusrészecskék összeállításában. Egyes vírusfehérjék további feladatokat is elvégeznek, mint a sejt mRNS-ének lebontása és a kibocsátott nukleotidok felhasználása vRNS szintéziséhez, ezáltal akadályozva a gazdasejt mRNS-ének fordítását.[61]
A vírus alkatrészei: a negatív értelmű RNS, az RNS-függő RNS-polimeráz, és a többi vírusfehérje összeáll virionná. A magfehérjék becsomagolják az RNS-t, a hemagglutininből és a neuraminidáz elkezd burokká összeállni a sejthártyához tapadva, ide belép a becsomagolt vRNS, miután elhagyta a sejtmagot. Ezután zárul a burok, az új vírus magával viszi a sejthártya egy részét.[62] A kilépéshez a neuraminidáz elbontja a sejt szialinsav maradványait.[55] Miután az új vírusok kiszabadultak, a sejt elpusztul.
Hibajavító enzimek hiányában az RNS-függő RNS-polimeráz körülbelül 10 ezer nukleotidonként hibázik; ez nagyjából a vírus genomjának hossza. Így az új vírusok többsége tartalmaz legalább egy mutáció; emiatt a felszíni fehérjék is előbb-utóbb változni kezdenek. Ezt nevezik az antigének sodródásának.[63] Ha egyszerre több vírus van jelen, akkor a genetikai állományuk össze is keveredhet. Ezt a jelenséget az antigének eltolódásának nevezik, ami hirtelen változást eredményez. Ez lehetővé teszi az alkalmazkodást új gazdafajokhoz, illetve az immunitás kijátszását.[51] Ez különösen a pandémiák alatt válik fontossá. Több vírus fertőzése esetén előfordulhat homológ rekombináció is, amikor nem teljes szálak keverednek, hanem másolás közben az enzim az egyik homológ szálról átvált egy másikra. Ez tovább növeli a rekombinációt.[64][65]
Tünetei

A fertőzések 33%-a tünetmentesen zajlik le.[69][70]
A betegség tünetei a fertőződést követően 1-3 nappal hirtelen kezdődnek: láz (38-39 °C), hidegrázás, elesettség, étvágytalanság, izomfájdalom, fejfájás, szédülés.[71] Később torokfájás és száraz köhögés is megjelenik. Előfordul fejfájás, fülfájás, rekedtség; irritált, könnyező szemek, vérömleny, orrfolyás és orrdugulás. Sok beteg napokra ágynak esik a testszerte kialakuló fájdalom miatt, amely a háton és a végtagokban a legerősebb.[72] Gyerekeknél lehetnek emésztőszervi tünetek is, mint hasfájás, hasmenés, hányás.[73][74] B típusú influenza esetén ezek súlyosak is lehetnek.[75] A láz 1–5 nap alatt megszűnik, majd napok–hetek múlva a többi tünet is elmúlik.
Szövődményként előfordulhat felső és alsó légúti gyulladás, tüdőgyulladás (mely időseknél és immunhiányos állapotúaknál gyakran halálos) és szívizomgyulladás (ez szintén halálhoz vezethet). A 2009-es pandémiát okozó H1N1 influenzavírus-törzs különösen veszélyezteti a terhes nőket: több, egyébként egészséges kismamának okozott halálos tüdőgyulladást.
Influenzában csökken a légutak védekezőképessége más kórokozókkal szemben, így gyakran lépnek fel egyidejűleg bakteriális fertőzések is (pl. Streptococcus, Staphylococcus, Haemophilus influenzae).
Nehéz elkülöníteni az influenza és a megfázás tüneteit, különösen kezdeti szakaszban.[76] Az influenza tünetei utalnak a megfázás mellett tüdőgyulladásra, kifáradásra, testszerte észlelhető fájdalomra, fejfájásra. Habár általában felnőtteknél nem fordulnak elő gyomor-bélrendszeri tünetek,[68] egyes szerotípusok, mint a H5N1 madárinfluenza, felnőtteknél is kiváltották őket.[77]
A láz és a köhögés jó előrejelző. Ha a láz 38 °C fölé emelkedik, a bizonyosság megnő.[78] Döntésanalízist használó tanulmányok[79][80] szerint helyi járvány esetén az átfertőzöttség meghaladja a 70%-ot.[80] Ha nincs járvány, akkor az influenzaszezon alatt az idősek 15%-án végigmegy.[80]
Az Amerikai Egyesült Államokban a Centers for Disease Control and Prevention (CDC) fenntartja tesztek napi frissítésű adatbázisát.[81] A CDC szerint a gyorstesztek érzékenysége 50-75%, specifikussága 90-95%, ha víruskultúrával hasonlítjuk össze.[82]
Az influenza alkalmanként súlyos betegséget is okozhat tüdőgyulladással, ahol az elsődlegesen vírusos tüdőgyulladást bakteriális tüdőgyulladás fertőzheti felül.[83][84] Ennek nyilvánvaló tünete a légzési nehézség. Ha egy gyerek vagy egy felnőtt először jobban lesz, majd felmegy a láza, az is figyelmeztető tünet, ami bakteriális tüdőgyulladásra utal.[85]
Az influenza időnként szokatlan tünetekkel jelentkezik, mint zavartság időseknél vagy szepszisszerű tünetekkel fiataloknál.[86]
Vészhelyzetet jeleznek ezek a tünetek:
- Légzési nehézség
- Mellkasi fájdalmak
- Zavartság
- Extrém hányás
- Visszaesés erős köhögéssel és magas lázzal
- Cianózis
- Magas láz kiütéssel
- Képtelenség ivásra
- Kiszáradás, például csecsemőknél a szokásosnál kevésbé nedves pelenkák[87] és könnyek hiánya síráskor
- Nem marad meg a folyadék a betegben
Terjedése
A beteg egy köhintéssel több mint félmillió vírust juttat a környezetébe.[88] Egyébként egészséges felnőtteknél a fertőzőképesség a fertőzés utáni fél-egy napon meredeken emelkedik, a második napon éri el a csúcsot. Ezután lassan csökkenni kezd, de öt napig az átlag környékén marad; a teljes fertőzőképes szakasz akár kilenc napig is tarthat.[69] Kísérleti fertőzésekben, ha vannak tünetek is, akkor a fertőzőképesség alakulása és a tünetek erőssége hasonló mintát követ, de a fertőzőképesség egy nappal megelőzi a tüneteket.[69] Gyerekek a tünetek megjelenése előtt egy nappal már fertőznek, és két hétig is fertőzőek maradnak.[89] Immunszuppresszió esetén a fertőzőképesség akár két hétnél tovább is fennáll.[90]
A terjedés többnyire a következő három módon történik: közvetlenül, levegőn át vagy mosatlan kézzel.[91][92] Közvetlen úton a beteg nyálkája a másik személy szemébe, szájába vagy orrába jut. Levegőn át, amikor a személy belélegzi azt a levegőt, amiben a vírusrészecskék vannak. Mosatlan kézzel, amikor a személy vagy a beteget, vagy az általa megfogott tárgyakat érinti, és utána nem mos kezet, mielőtt a szeméhez, szájához vagy orrához nyúlna. Ez a három mód jellemző a cseppfertőzéssel terjedő betegségekre. Relatív fontosságuk nem ismert.[2] A levegőbe kiköhögött cseppek mérete 0,5 – 5 μm; és egyetlen csepp annyi viriont tartalmaz, amennyi képes fertőzést okozni.[91] Egy köhintésben úgy 40 000 csepp van,[93] viszont ezek legtöbbje nagy, és nem jut messzire.[91] A terjedésre hat a levegő páratartalma és az ultraibolya sugárzás; télen mindkettő alacsony, ami kedvez az influenzának,[91] így az akár egy órán át is fertőzőképes marad a levegőben.[94]
Az influenza képes terjedni pénzzel,[95] jegyzetpapírral, ajtókilincsekkel, villanykapcsolókkal és más háztartási eszközökkel.[72] A vírus túlélési ideje függ a felszín anyagától: kemény, nem porózus felszíneken, mint fém és műanyagok egy-két nap, száraz papíron tíz-tizenöt perc, bőrön öt perc.[96] A nyálka segít a vírusok túlélésében, így papíron akár 17 napig is fertőzőképesek maradhatnak.[91][95] A madárinfluenza fagyasztva meghatározatlan ideig eltartható.[97] A hőt kevésbé bírja, legalább 60 perces melegen tartás 56 °C-on inaktívvá teszi. Hasonlóan a túl savas környezetet sem bírja, 2 pH-n alul elpusztul.[97]
Fiziológiája
Elméletek szerint az egyik mechanizmus az adrenokortikotrop hormon gátlása, ami alacsony kortizolszintet idéz elő.[98] A genetikai anyag tanulmányozása segít előre jelezni, mennyire képes az adott altípus fertőzni az embert, illetve milyen erős betegséget okozhat.[45][99]
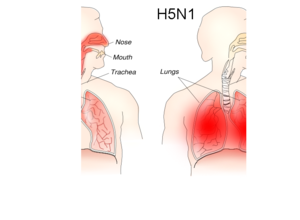
Például a sejtbe való belépést a hemagglutinin proteolízise teszi lehetővé, melyet a sejtben levő proteázok idéznek elő.[56] Ha erre csak azok a proteázok képesek, amelyek csak a torokban és a tüdőben találhatók meg, akkor a vírus csak ezeket a szöveteket fertőzheti meg. Ezzel szemben az erős altípusok, mint a H5N1 hemagglutininjét többféle proteáz képes bontani, így az több szervet is elér a testben.[99]
Szintén a hemagglutinin határozza meg, hogy a vírus mely fajokat képes fertőzni, és hogy emberben a légző szervrendszeren belül mely szövetek érzékenyek rá.[100] Az inkább a felső légutakat (orr, száj, torok) elérő altípusok könnyebben terjednek, viszont nem okoznak súlyos megbetegedést.[101] Ellenben a halálosabb altípusok, mint a H5N1 inkább az alsó légutakat támadják, azonban kevésbé képesek terjedni.[102] Így például a H5N1 influenza is nehezen terjed köhögéssel.[103][104]
Az általános tüneteket, mint láz, fejfájás, elesettség a gyulladáskeltő citokinek és kemokinek megnövekedett mennyisége okozza, amelyeket az influenza által megtámadott sejtek termelnek.[76][105] Szemben a náthával az influenza károsítja a szöveteket, így a tüneteket nem lehet csak a gyulladásnak tulajdonítani.[106] Ez az erős immunválasz akár citokinvihart is kiválthat, ami a beteg életébe kerülhet. Ezzel magyarázzák a spanyolnátha és a H5N1 madárinfluenza által okozott haláleseteket. Egy másik magyarázat szerint a citokinvihart a vírusok gyors szaporodása eredményezi, és nem az immunválasz.[107] Az influenza miatt gyakoribbá válik a programozott sejthalál.[108]
Felismerése

Számos gyorsteszt képes igazolni, hogy a fertőzést influenza okozza. A kimutatáshoz az orrból vesznek mintát,[109] így csak a tünetek megjelenése utáni negyedik napig lehetséges ezekkel diagnosztizálni, mivel utána csökken ott a vírusok száma.[86]
Kezelése
A beteg leggyakrabban magától meggyógyul; javasolt az ágynyugalom, valamint fontos a megfelelő folyadékpótlás. Javasolják a dohányzás és az alkoholos italok mellőzését. A betegnek tanácsos kerülnie a társaságot, különösen a kockázati csoportba tartozók: várandós nők, csecsemők, idős, immunszuppresszáltak és beteg emberek társaságát.[110][111] Lázcsillapítás akkor javasolt, ha a betegség rendkívüli szenvedést okoz a betegnek; különben nem ajánlott. Erős fájdalmak esetén is adható acetaminophen (paracetamol).[110][111]
Az influenza kezelhető neuraminidáz-bénítókkal (oszeltamivir, zanamivir, laninamivir és peramivir),[112] valamint a csak influenzavírus A ellen hatásos adamantán-származékokkal (amantadin, rimantadin),[113] melyeket a betegség elejétől már szedni kell. Oroszországban az umifenovirt használják, aminek 2020 első negyedévében 16%-os részesedése volt az antivirális piacon.[114]
A neuraminidáz-bénítók az egyébként egészséges betegeknél nem tűnt nagyobbnak, mint a vele járó kockázatok. A más egészségügyi problémájú betegeken nem segített.[11] Azoknál, akiket influenzával gyanúsítottak, a tünetes szakasz legfeljebb egy nappal rövidült le, viszont csökkentette a kórházi kezelésre szorulást és a tüdőgyulladás valószínűségét.[12] A neuraminidáz-bénítókkal szemben kialakuló rezisztencia további vírusellenes gyógyszerek kifejlesztésére késztette a szakembereket.[115]
Az amantadin és a rimantadin az m2-gátlók csoportjába tartozik. Mechanizmusuk a vírus m2 csatornájának blokkolása.[59] 2005-ben Amerikában a H3N2 influenza rezisztenciája 91%-kal nőtt.[116] Ennek oka, hogy Kínában és Oroszországban a megfázást is ezzel kezelték,[117] valamint a baromfitelepeken megelőzésként adták.[118][119] A CDC ellenezte az m2-gátlók adását a 2005/2006-os influenzaszezonban.
Szalicilátok (pl. aszpirin) nem adhatók influenzás gyermekeknek, mert a vírusfertőzés és a szalicilát együttesen súlyos (gyakran halálos) agy- és májkárosodást (Reye-szindrómát) okozhat.[120]
A kortikoszteroidok alkalmazását nem támasztják alá bizonyítékok.[121] Antibiotikumok csak a felülfertőzések ellen adhatók. A vírusellenes szerek hatékonyak az első napokban; a kockázati csoport tagjai számára ezért az orvosnak fel kell írnia őket. A leggyakrabban használt szerek ellen úgy látszik, hogy rezisztencia kezd kialakulni, ám ennek bizonyítására további kutatás szükséges.[122] Azok, akik különösen súlyos tüneteket tapasztalnak, kórházi kezelésre szorulnak.[87]
Kimenetele
(Lásd még: #Halálozás)

Az influenza hatásai súlyosabbak és tovább tartanak, mint a megfázásé. A legtöbb ember teljesen meggyógyul egy-két hét alatt, de néhány betegben életveszélyes szövődmények alakulnak ki, például tüdőgyulladás. Halált is okozhat; kockázati csoportjába tartoznak a fiatalok, az idősek, az immungyengítettek, és a krónikusan betegek.[51] Az immunhiányosak, mint pl. a HIV-pozitívok vagy a szervátültetettek súlyos tüneteket élnek meg.[123] A terhes anyák és a fiatal gyerekek számára szintén gyakran jár súlyos tünetekkel.[124]
Az influenza tovább súlyosbíthatja a krónikus egészségügyi problémákat. Az emphysema, krónikus hörghurut, asztma légzési nehézségét; a koszorúér-betegség és a szívelégtelenség is súlyosbodik.[125] További kockázati tényező a dohányzás, ami növeli a tünetek súlyosságát és akár halálossá is teheti az influenzát.[126] További szövődmények a hörghurut, a homloküreg-gyulladás és a fülfertőzések. A kockázati csoportokba nem tartozóknál is kialakulhatnak, de náluk ritkábban.[127]
Bizonyos esetekben az influenzára adott autoimmun válasz hozzájárul a Guillain–Barré-szindróma kialakulásához.[128] Bár más betegségek is hozzájárulnak a szindróma kialakulásához, járványok alatt az influenza szerepe megnő.[128][129] Vizsgálatok alapján millió oltásból egyszer fordul elő ez a kórkép.[130] Azonban az influenza fertőzés ennél jóval több esetet vált ki. 10 ezer betegből egy meghal, és 100 ezer esetből egynél fordul elő Guillain–Barré-szindróma.[128][131]
A Centers for Disease Control and Prevention (CDC) szerint gyerekek bizonyos idegrendszeri állapotai is súlyosbítják az influenza lefutását, ami akár tüdőgyulladást, illetve halált is okozhat. A megadott betegségek és rendellenességek:[132]
- Az agy és a gerincvelő rendellenességei
- Cerebral palsy
- Epilepszia
- Stroke
- Értelmi fogyatékosság
- Megkésett fejlődés
- Izomdisztrófia
- Gerincvelő sérülése
Mindezek érinthetik a köhögést, nyelést, a légutak tisztítását, a legrosszabb esetekben a nyelést, ami miatt az influenza lefutása súlyosabb lehet, mint egyébként.[132]
Megelőzése
Az influenzás megbetegedésének esélye különböző praktikák betartásával csökkenthető. Ilyen például a probiotikus ételek fogyasztása, a szabadtéri tartózkodás és párásítás, a megfelelő alvás, a beteg emberek viszonylagos elkerülése.[133]
Az ellenőrzött kutatások és szilárd bizonyítékok híján nem tudhatjuk, hogy melyik intézkedés mennyire hatékony. A szakértők azonban ajánlnak olyan általános szabályokat, mint a higiénia, a betegek elkülönítése, maszkok használata a betegek és gondozóik által, a fertőtlenítés, gyorstesztelés és diagnózis, illetve a kontaktkutatás. Egyes esetekben ajánlják a szociális távolságtartást iskolabezárásokkal és utazási korlátozásokkal.[134]
A betegség terjedését akadályozzák a jó személyes higiéniai szokások, mint:
- a szem, száj és orr érintésének kerülése;[135] ha mégis meg kell érinteni, akkor azt csak frissen mosott kézzel
- gyakori kézmosás szappannal és vízzel, illetve alkoholos fertőtlenítőkkel[136]
- zsebkendőbe vagy ruhaujjba köhögés és tüsszentés[134]
- betegség esetén otthon maradás
- a köpés kerülése; ha mégis, akkor azt ne a padlóra, hanem zacskóba vagy szövetanyagba
Habár az arcmaszk védhet a betegről való gondoskodás közben,[137][138] a közösségben való hordással szemben az eredmények ellentmondásosak. A dohányzás növeli az influenzafertőzés kockázatát, és a tünetek súlyosságát.
A terjedés megakadályozására alkalmazták a szociális távolságtartást, karantént, utazási korlátozásokat, iskolák, templomok, színházak bezárását. Kutatók becslése szerint az 1918-as influenzajárvány halálozását az Amerikai Egyesült Államokban 50%-kal, világszerte 10–30%-kal csökkentette azokon a területeken, ahol több intézkedést vezettek be. A mérsékeltebb sikert annak tulajdonítják, hogy vagy túl későn vezették be, vagy túl korán, hat hét után feloldották a korlátozásokat.[139][140]
Az utazás korlátozása és a tömegrendezvények tiltása tipikus influenzajárvány esetén népszerűtlen, ezért ritkán alkalmazzák. A legtöbb tapasztalati tanulmány szerint az iskolabezárások csökkentették a terjedést, mások szerint az eredmények ellentmondásosak. Az ajánlásokhoz figyelembe kell venni az eset jellegét.[134]
Immunitás
Az immunrendszer a hemagglutinin és neuraminidáz glikoproteineket ismeri fel antigénként, ellenük antitestek termelődnek. A hemagglutinin elleni antitestek csökkentik a fertőzés valószínűségét (neutralizáló ellenanyagok), a neuraminidáz-ellenes ellenanyagok pedig a betegség súlyosságát és a beteg fertőzőképességét csökkentik.
Antigen drift esetén a megváltozott antigenitású vírus képes lehet megbetegíteni a korábbi változat ellen védett egyedet, de a betegség lefolyása enyhébb. Antigen shift során viszont olyan új vírustörzsek keletkezhetnek, amelyek ellen a szervezet védtelen.
A fertőzött sejtek elpusztításában citotoxikus T-limfociták vesznek részt.
Védőoltás

Influenza megelőzésére adható neuraminidáz-bénító vagy védőoltás. A vakcina elölt teljes vírust, hasított vírust vagy csupán felszíni antigéneket (hemagglutinint és neuraminidázt) tartalmaz, mégpedig az adott évben várható legelterjedtebb influenzavírus A és B altípusokat. A WHO ajánlja a védőoltást azoknak, akiknél magas az influenza szövődményeinek kockázata: időseknek, krónikus betegségben szenvedőknek és immunhiányosoknak.[141][142] Oltandók továbbá a gyermeket tervező vagy a már teherbe esett nők, illetve az öt éven aluli gyerekek is. Javasolják krónikus betegségek esetén, mint cukorbetegség, asztma, HIV-fertőzöttség, AIDS, szívbetegségek, illetve szerátültetés utáni immunszuppresszált állapotban is. Az egészségügyben dolgozóknak is javallott beoltatniuk magukat. A Centers for Disease Control and Prevention (CDC) szerint hathónapos kortól alkalmazható.[143][10]
Egészséges felnőtteknél mérsékelten hatékony a tünetek csökkentésében.[144] Gyerekeknél kétéves kortól a harmadára csökkenti az influenza elkapásának esélyét. Kétéves kornál fiatalabb gyerekeknél nem vizsgálták.[145] Krónikus obstruktív légúti betegség esetén az influenzaoltás csökkenti a váladék termelését;[146] asztmánál ez még nincs bizonyítva.[147] Az oltással elérhető, hogy a HIV/AIDS-esek, a szervátültetettek és a rákosok esetén csökkenjenek az influenzaszerű tünetek.[148] Csökkentheti a szívbetegség kockázatát.[149] Az egészségügyi dolgozók immunizációjának hatásáról egyesek ellentmondásos adatokat találtak,[150][151] míg mások gyenge bizonyítékokat.[152][153]
A vírus mutációs sebessége miatt a védőoltások csak néhány évig hatásosak; emiatt a WHO minden évben meghatározza, hogy mely vírustörzsekre lehet számítani. Ennek ismeretében a gyógyszergyártók ki tudják fejleszteni a megfelelő oltást.[154] Ezen minden szezonban igazítanak, hogy kövessék a leggyakoribb törzsek változásait, a teljesség igénye nélkül. A teljes folyamat hat hónapot vesz igénybe, így előfordulhat, hogy egy olyan törzs terjed el, amire nem számítottak, így nincs az oltásban.[155] A védelem az oltást követő két hét alatt válik aktívvá,[156] tehát lehetséges még ebben az időszakban megfertőződni azzal a vírussal, ami ellen az oltás véd. Habár az oltásban nincs működőképes vírus, az immunrendszer reagálhat úgy, mintha valódi fertőzésről lenne szó. Ekkor azonban a tünetek rendszerint enyhébbek. A legveszélyesebb az allergiás reakció az oltásban levő anyagokra, amelyek származhatnak a vírusból vagy a tenyésztésre használt tojásból.[157]
Egy 2018-as Cochrane cikk szerint a jó általános egészségű gyerekeknél az élő immunizáció csökkentette a szezonális influenza arányát 18%-ról 4%-ra. Az inaktív oltás esetén az arány 30%-ról 11%-ra csökkent. Nem állt rendelkezésre elég adat ahhoz, hogy következtessenek a súlyos szövődményekre, mint a tüdőgyulladás, vagy a kórházi kezelés szükségességére.[145]
Egészséges felnőtteknél egy másik 2018-as Cochrane cikk szerint a tesztekkel megerősített influenza gyakorisága 2,3%-ról 0,9%-ra csökkent.[144] Ez 60%-os csökkenés. Az influenzaszerű tünetek gyakorisága 21,5%-ról 18,1%-ra csökkent, ami egy jóval szerényebb eredmény, 16%. A magyarázatot az a több mint 200 vírus adja, melyek nem influenzavírusok, de influenzaszerű tüneteket okoznak. Egy további cikk szerint az oltás előtti testmozgás nem befolyásolta az oltás sikerét.[158]
A szezonális influenza elleni védőoltás költséghatékonyságát különböző körülmények között és különböző csoportoknál vizsgálták.[159] Általában költséghatékonynak találták, különösen gyerekeknél[160] és időseknél;[161] azonban gyakran úgy találták, hogy ez más körülményeken múlik.[162][163]
Járványtana
Szezonális jelleg

Az influenzás megbetegedések száma télen éri el csúcspontját. Mivel az északi és a déli féltekén máskor van tél, azért évente két influenzaszezon van. A WHO ezért kétféle ajánlást készít a védőoltás előállításához: egyet az északi, egyet a déli félteke számára.[154] Az influenza szezonális jellegének okát nem ismerjük tudományos pontossággal. Az elfogadott magyarázat szerint az emberek többet tartózkodnak zárt térben, közelebbi kapcsolatba kerülnek egymással, ami segít a vírus terjedésében. Az északi féltekén a téli utazások szintén hozzájárulhatnak.[164] Egy további tényező, hogy a hideg levegő szárazabb, amitől kiszáradnak a kitüsszögött cseppek. Ettől könnyebbek és kisebbek lesznek, így tovább képesek a levegőben maradni. A vírus tovább marad fertőzőképes hideg tárgyakon, továbbá aeroszollal való terjedéséhez is kedvező az 5 °C alatti hőmérséklet.[165] A legfontosabb tényezőnek a levegő szárazsága látszik.[166][167]
Trópusi területeken is előfordul, hogy van influenzaszezon, ami a fentiekkel ellentétben az esős évszakra esik.[168] Az iskolai tanítás időszaka játszhat ebben szerepet, ahogy a gyermekbetegségek esetén is. A kisebb évszakos hatások eredményei felnagyítva tükröződnek a betegségek helyi ciklusában.[169] A H5N1 nemcsak az embereknél, hanem a madaraknál is ciklikus.[170][171]
Egy alternatív elmélet szerint a D-vitamin szintje sokkal fontosabb.[172] Ezt az elméletet Robert Edgar Hope-Simpson alkotta meg 1981-ben.[173] A D-vitamin a bőrben termelődik UV-sugárzás hatására. Ez magyarázza az influenzaszezont a téli és az esős évszakban is, hiszen ekkor az emberek többet vannak zárt helyen, így kevesebb napsütés éri őket, amitől kevesebb D-vitamin termelődik.
Halálozás

A halálos áldozatok száma évi 290 000 és 650 000 közötti, átlagosan 389 000.[175] A fejlett világban leggyakrabban 65 éven felüliek halnak bele.[1] A fejlődő országokban nincs ilyen világos összefüggés, azonban úgy látszik, hogy a gyerekek gyakrabban érintettek.[1]
Habár az esetszám évről évre erősen változó, az Amerikai Egyesült Államokban körülbelül évi 200 000 kórházi kezelés és 36 000 halálozás köthető az influenzához.[176][177] Az egyik becslési módszer évi 41 400 halálozást adott 1979 és 2001 között.[178] Centers for Disease Control and Prevention (CDC) 2010-es becslései módszertől függően évi 3 300 és 49 000 közötti halálozási számot adtak.[179]
Járványok
(Lásd még: #Pandémiák)

Influenzát különböző típusú és altípusú vírusok okoznak. Egy adott évben egyes altípusok eltűnhetnek, míg mások helyi járványokat vagy pandémiákat okozhatnak. Az évi két szezonban (északi illetve déli) általában három-öt millió esetben alakul ki súlyos betegség,[1][13][181] ami bizonyos definíciók szerint járvány.[1]
Pandémia többnyire évszázadonként háromszor alakul ki, ami megfertőzi az emberek nagy részét, és tízmilliók halálát okozhatja. Egy 2006-os cikk szerint, ha az az évben felbukkant új influenza virulenciája ugyanakkora lett volna, mint a spanyolnátha kórokozójáé, akkor az 50-80 millió halált okozott volna.[182]
Újabb altípusok mutációval vagy különböző altípusok keveredésével jönnek létre.[36] A mutációk kisebb változtatásokat okoznak a hemagglutinin és neuraminidáz felszíni fehérjékben. Ez az antigénsodródás, amelynek eredményeként előbb-utóbb akkora változás halmozódik fel, hogy az új vírus képes olyan szervezeteket is megfertőzni, melyek már immunisak a korábbi vonalakra. Ezután ez az új altípus válik dominánssá, végigsöpörve az emberi népességen, gyakran járványt okozva.[183] Mivel azonban még mindig hasonlít a korábbi típusokhoz, azért mégis akadnak olyan emberek, akik immunisak az új altípusra. Azonban, ha például emberi és madárinfluenza típusok genetikai anyaga keveredik, akkor az új vírusok nem hasonlítanak semmilyen korábbi altípushoz, így mindenki védtelen lesz velük szemben, ami pandémiát okoz.[184] Egy másik lehetséges ok a pandémiára az emberi népességben jelen levő altípusok és a változó immunitás az emberek körében.[185] Egy másik elmélet szerint a pandémiák oka a fix vírustörzsek és a változó immunitásnak a kölcsönhatása.[186]
Közegészségügyi szempontból az influenzajárványok gyorsan terjednek, és nehezen kontrollálhatók. A legtöbb altípus nem különösebben fertőző: a legtöbb beteg legfeljebb egy-két embert fertőz meg; az alap reprodukciós szám 1,4. A generációs idő viszont rövid, a fertőződést követő második napon már továbbadódnak a vírusok. Ez azt is jelenti, hogy a járvány két hónap után tetőzik, és három hónap után véget ér. Emiatt a beavatkozásról is gyorsan kell dönteni, ezért a döntés pillanatában még kevés adat áll rendelkezésre. Egy további probléma, hogy az influenza már akkor fertőz, amikor a beteg még tünetmentes, tehát a tünetek jelentkezése utáni elkülönítés nem hatékony.[180] Általában a fertőzőképesség a második napon éri el csúcsát, és csak azután, a harmadik nap lesz a legsúlyosabb a betegség.[69]
Története
Nevének eredete
Az influenza név latin eredetű, és befolyásolást jelent. Ez arra a hiedelemre utal, hogy a betegséget a kedvezőtlen csillagállások okozzák.[187] További elnevezések más nyelveken: epidemic catarrh,[188] sweating sickness,[189] la grippe (francia, németbe is átkerült; Molyneaux használta először 1694-ben).[188]
Pandémiák

A világméretű járványokat pandémiáknak nevezzük. Az A-influenzavírus gyakran idéz elő pandémiát.
Az 1500 előtti időszakra információhiány jellemző.[191] Feltehetően az első influenzajárvány Kínában tört ki, i. e. 6000 körül.[191] Hippokratész tisztán és világosan leírta a tüneteit i. e. 400 körül.[192][193] Habár a vírus többször is okozott pandémiát a történelem során, ezt nehéz bizonyítani, mivel más légúti fertőzések hasonló tünetekkel járnak.[188][194] Amerika felfedezése után hamarosan az influenza is átkerült Amerikába, mivel 1493-ban az Antillák teljes őslakosságát kiirtotta egy járvány, amelynek tünetei az influenzára emlékeztetnek.[195][196]
Az első feljegyzett pandémia 1510-ben tört ki Kelet-Ázsiában. Innen Észak-Afrikába, majd Európába jutott. A betegek 1%-a halt meg.[197][198] Az 1557-es pandémia már az ismert világ nagy részére kiterjedt.[199][200][201][202] Egy visszatérő hulláma 12 órás különbséggel megölte I. Mária angol királynőt és Reginald Pole Canterbury érseket.[203][204] A 16. század legjobban feljegyzett pandémiája 1580-ban tört ki Kelet-Ázsiában, majd Afrikán, Oroszországon, Spanyolországon és a Török Birodalmon keresztül Európába jutott. Rómában 8000 beteg halt meg, több spanyol város ennél nagyobb arányú veszteséget szenvedett. Többek között Habsburg Anna spanyol királyné is életét vesztette. A 17. és a 18. század pandémiáiról szórványos tudósításokat ismerünk. A 19. században az 1830–1833-as pandémia volt a legszélesebb körű: minden negyedik ember, aki ki volt téve a fertőzésnek, elkapta.[188]
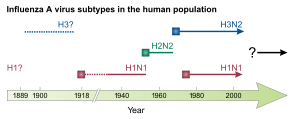
A legutóbbiak:
- 1889: orosz nátha (H2N2)
- 1918: spanyolnátha (H1N1)
- 1957: ázsiai influenza (H2N2)
- 1968: hongkongi influenza (H3N2)
- 2009-es influenzapandémia[205] (H1N1)
A halálossága miatt hírhedt spanyolnátha 1918-ban tört ki, és 1920-ban ért véget. A halálos áldozatok száma nem ismert, a becslések 17 millió és 100 millió közé teszik.[15][190][206][207] Halálosságát a fekete haláléhoz hasonlították.[188] A halálosság oka a könnyű terjedés volt, a fertőzés rátája elérte az 50%-ot, és tünetei is nagyon súlyosak voltak, feltehetően citokinvihar miatt.[207] A tünetek is szokatlanok voltak az influenzánál, így eleinte Dengue-lázként, koleraként, tífuszként félrediagnosztizálták. Egy megfigyelő szerint a legsúlyosabb szövődmény a nyálkahártyák vérzése volt, különösen az orr, a gyomor és a belek vérzése. A fül és a bőr vérzése is előfordult.[206] A vezető halálozási ok a bakteriális tüdőgyulladás volt, de közvetlenül is ölt, masszív vérzésekkel és tüdőödémával.[208]
A spanyolnátha tényleg világjárvány volt, még a Csendes-óceán szigeteire és az Északi-sark vidékére is eljutott. A fertőzöttek 2-20%-át meg is ölte, szemben az influenza szokásos 0,1%-ával.[190][206] Egy másik szokatlan jellemző a halottak életkora volt: 99%-ban 65 éven aluliak, és többségében 20-40 évesek haltak meg.[209] Ez is szokatlan, hiszen a legtöbb halálos áldozat életkora többnyire 2 éven aluli vagy 70 éven felüli. A teljes népességre vetített halálozás nem ismert, becslések szerint 2,5% és 5% közötti. Az első 25 hét alatt 25 millióan vesztették életüket; ehhez a HIV vírusnak 25 év kellett.[206]
A további pandémiák nem voltak ilyen halálosak, azonban az 1957-es és az 1968-os pandémiák is millió halált okoztak. Később már rendelkezésre álltak antibiotikumok a másodlagos fertőzések kivédésére.[190]
(Lásd még: #Járványok)
2009-es pandémia

2009-ben egy új H1N1 vírus jelent meg, amely részben házisertés- (kis részben madár-) és részben emberi A-vírusból származik. Szerkezetében különbözik az eddigi H1N1 vírusoktól. Az emberek nagy része – a 65 éven felüliek egy részének kivételével – még nem találkozott ezzel a vírussal, ezért fogékony a fertőzésre. Így világméretű járvány – ún. pandémia – alakult ki. Az influenza tünetei sokban megegyeznek a nátha tüneteivel, de a betegség súlyosabb lefolyású. Általában magas lázzal jár, fejfájás, izomfájdalmak, száraz köhögés, levertség és gyöngeség jellemzi. A torokfájás ritka, és csak az esetek 30–50%-ában jelenik meg orrfolyás, orrdugulás. Szövődményei főleg várandós nőkben, kisgyermekekben, idősekben és krónikus betegségben szenvedőkben veszélyesek. Ezek között leggyakoribb a különböző baktériumok okozta tüdőgyulladás, mely antibiotikumokkal kezelhető. Ritkán az influenza első tünete a vírus által okozott vérzéses tüdőgyulladás lehet, amelynek halálozása nagyon magas. Az influenza kezelésére léteznek gyógyszerek, az ún. antivirális szerek csoportjába tartozók, ezek a tünetek enyhítésére, a betegség időtartamának lerövidítésére alkalmasak, de csak a megbetegedés első 1-2 napján elkezdve hatásosak.
Kutatásaszerkesztés
Kezdetben tévesen úgy gondolták, hogy az influenzát baktérium okozza. 1892-ben R. F. J. Pfeiffer azt hitte, hogy felfedezte az influenza kórokozóját, a Haemophilus influenzae baktériumot.[211] A kutatók csak 1901-ben jöttek rá, hogy ez tévedés volt, amikor baromfik madárinfluenzája áthatolt a Chamberland szűrőkön, amelynek pórusai olyan aprók, hogy a legkisebb baktériumok sem hatolhatnak át rajta.[212] Azonban még eltartott egy ideig, amíg felismerték, hogy a baktériumok és a vírusok különböző entitások, ami bonyolultabbá tette a spanyolinfluenza elleni védekezést.[211] Magát az Orthomyxoviridae víruscsaládot Richard Shope azonosította sertésekben 1931-ben.[213] Hamarosan (1933) az embertől származó vírust is elkülönítették Patrick Laidlaw vezetésével az Egyesült Királyság Medical Research Council intézetében.[214] A vírusok nem sejtes természete azonban egészen 1935-ig ismeretlen maradt, amikor Wendell Stanley először kristályosította a dohánymozaikvírust.
Az első lépést az influenza megelőzésére ifjabb Thomas Francis tette meg 1944-ben, elölt vírusokat tartalmazó védőoltásával. Ebben Frank Macfarlane Burnet eredményére hagyatkozott, aki megmutatta, hogy megtermékenyített tyúktojásban tenyésztve a vírus veszít virulenciájából.[215] A védőoltás katonai támogatással készült a Michigan Egyetemen.[216] Az amerikai hadsereg azért volt érdekelt az influenza kutatásában, mivel a vírus hónapok alatt csapatok ezreit ölte meg.[206] Az oltással szemben a gyógyszerfejlesztés lemaradt, az amantadint 1966-ban, majd a neuraminidáz-gátlókat három évtizeddel később vezették be.[217]
Az influenza kutatása magában foglalja a molekuláris virológiát, a betegség keletkezésének fiziológiáját, a gazda immunválaszát, a vírusgenomikát és a vírus terjedésének tanulmányozását. A tudományos eredmények birtokában növelik a védekezés hatékonyságát: az immunválasz a védőoltások kifejlesztésében; a sejtekbe való behatolás pontosabb ismerete a gyógyszerek fejlesztésében segít. Az egyik legfontosabb alapkutatási program a vírusgenom szekvenálását célozza, mely 2004-ben kezdődött. Az influenza szekvenciáinak ismerete segít megérteni, mitől válik a vírus halálossá, amely gének alapján ismeri fel az immunrendszer a vírust, és nyomon követni az influenza evolúcióját.[218]

Kiegészülve a rekombináns DNS-technológiával a szekvenálás felgyorsítja a védőoltások kifejlesztését, így a korábban kifejlesztett oltásokba új antigének tehetők.[219] Sejtkultúrában tenyésztve a vírusokat alacsonyabb költséget, jobb minőséget és nagyobb kapacitást tudnak elérni.[220] Folyamatban van az általános A típusú influenza elleni oltás kifejlesztése a vírus M2 transzmembrán fehérjéjét célozza, melyen Walter Fiers, Xavier Saelens és csapatuk dolgozik a Ghent Egyetemen, és túl van az első klinikai kísérleti fázison.[221][222][223] Cél az univerzális influenza elleni védőoltás kifejlesztése is, amelyet ritkábban változó fehérjékre alapoznak, így az oltás nem egy-két évre, hanem annál tovább lesz képes minden influenza ellen védettséget nyújtani.[224][225][226]
Vizsgálnak különböző, már használatban levő szereket is influenza szempontjából. Feladatuk az immunválasz aktiválása a vírussal, illetve antigénekkel szemben. Stimulálják a limfocitákat, a makrofágokat és az antigén prezentáló sejteket, hogy immunválaszt váltsanak ki a vírus citotoxikus hatásával szemben. A profilaktikus és terápiás szerek hatásának tesztelésére egérinfluenza modellt használnak. Például a limfocita T-sejt immunomodulátor akadályozza a vírus terjeszkedését az influenza egér modelljében.[227]
Hatása a kultúrára és a társadalomraszerkesztés
Az influenza közvetlen költségeket okoz a termelékenység csökkenése és a hozzá kapcsolódó orvosi kezelés miatt. Az Amerikai Egyesült Államokban a szezonális influenza 11 milliárd dolláros költséget okoz, melyből a közvetlen orvosi költségek több mint hárommilliárd dollárt tesznek ki.[228] Becslések szerint egy pandémia által okozott költség 100 milliárd dolláros nagyságrendű lenne.[229] Azonban nem vizsgálták a múltbéli pandémiák gazdasági hatását. Egyes szerzők szerint a spanyolnátha hosszú távú gazdasági hatása pozitív volt, növelte az egy főre jutó jövedelmet, annak ellenére, hogy rövid távon válságot és a dolgozók számának csökkenését okozta.[230] Más tanulmányok megpróbálják egy, a spanyolnáthához hasonló pandémia hatását megbecsülni, ami a dolgozók 30%-ának megbetegedésével és 2,5%-ának elhalálozásával jár. Háromhetes betegséggel számolva a GDP 5%-kal csökken. További költségeket okoz 18-45 millió beteg orvosi ellátása, így az összköltség elérheti a 700 milliárd dollárt.[231]
Még a megelőzés sincs ingyen. A potenciális H5N1 madárinfluenza pandémia megelőzésére milliárd amerikai dollárnak megfelelő összeget költöttek a világ kormányai. Ebbe beletartoznak a védőoltások és a gyógyszerek, a határvédelem megerősítése és a vészhelyzetekre való felkészülés.[232] 2005 november elsején George W. Bush nyilvánosságra hozta nemzeti stratégiáját a pandémia elleni védekezésre,[229] amelyre 7,1 milliárd dollárt kért a kongresszustól.[233] Egy kínai konferencia alkalmából szervezett nemzetközi gyűjtésen két nap alatt 2 milliárd dollár gyűlt össze.[234][235]
A 2009-es H1N1 influenza pandémia alkalmából a déli féltekén végzett kutatások szerint a vizsgált országokban a szocioökonómiai hatások elszigeteltek és időlegesek voltak. Ide tartozott a turizmus gyengülése is a vírustól való félelem miatt.[236]
Más fajoknálszerkesztés

Az influenza sok állatfajt képes megfertőzni; a különféle altípusok átkerülhetnek egyik fajról a másikra. Az influenza fő hordozóinak a madarakat tekintik.[237] A legtöbb emberi altípus körülbelül 10 000 évvel ezelőttől ismert, amikor megkezdődött az állatok nagybani háziasítása.[238] A hemagglutinin tizenhat és a neuraminidáz kilenc típusát azonosították. Ezek összes párosítását megtalálták madarakban, viszont egyes altípusok endemikusak különféle emlősökben, mint ember, kutya, ló, sertés; szintén saját influenzavariánsokkal bírnak a következő fajok egyes populációi: tevék, vadászgörények, macskák, fókák, cetek, nyércek.[40] Néha az adott faj nevével utalnak az adott influenzára, így szóba kerül az ember influenzája mellett madárinfluenza, sertésinfluenza, lóinfluenza és kutyainfluenza. A macskanátha vagy macskainfluenza egy egészen más vírusos betegségre utal, aminek nem sok köze van az influenzához. A tünetek lovakban, kutyákban, sertésekben az emberéhez hasonlóak: láz, köhögés. étvágytalanság.[40] A betegség terjedését nem figyelik annyira, mint az embereknél, viszont az 1979–1980-as szezonban Új-Anglia partjainál a kikötői fókák közül 500-at ölt meg a járvány.[239] Ezzel szemben a sertésinfluenza gyakori, de csak ritkán halálos.[40] A baromfik számára oltásokat tartanak karban a madárinfluenza megelőzésére és kezelésére.[240]
Madarakbanszerkesztés
A madárinfluenza változékony, és nem specifikus tüneteket okoz madarakban.[241] Tünetek lehetnek a felborzolt tollazat, a csökkent termékenység, a súlyvesztés vagy a légzőszervi tünetek.[242] Ezek a tünetek felvetik a gyanút, de a pontos diagnózis labormunkát igényel. Virulensebb altípusok, mint a H9N2, súlyosabb tüneteket és magasabb halálozási arányt okoznak.[243] A legpatogénebb altípusoknál a tünetek hirtelen jelennek meg, és a házityúkok és a pulykák majdnem 100%-a két napon belül belehal.[244] Intenzív tartásban a tömeges körülmények miatt a tünetek gyorsan terjednek, ezzel a gazdasági kár is óriási lehet.
A madarakhoz adaptálódott H5N1 erősen patogén influenza sok madárpopulációban endemikus, különösen Délkelet-Ázsiában. Ennek HPAI A(H5N1) ázsiai ága okozta a madárinfluenza pandémiát. Ezzel egyidőben epizoózisa (más fajok körében terjedő világjárványt) is zajlott, ami több állatfajra is kiterjedt, azaz pánzoózis is volt. Madarak tízmilliói estek áldozatául, és a terjedés megakadályozása érdekében több mint százmillió további madarat áldoztak fel. A médiában többnyire madárinfluenzaként emlegették.[245][246]
2013 márciusában a kínai kormány a H7N9 három esetét jelentette be, akik közül két ember meghalt, egy pedig súlyosan megbetegedett. Habár tagadták, hogy terjedne emberről emberre, április közepén 82 esetet ismertek, 17-en meghaltak.[247][248] Ezek közé tartozik három sanghaji családi klaszter, és Pekingben egy szomszéd fiúból és lányból álló klaszter. Habár ez felvetette az emberről emberre terjedés lehetőségét, mégsem fogadták el bizonyítéknak. A WHO szerint szoros kontaktus esetén volt képes emberről emberre terjedni, de nem annyira, hogy járványt okozzon.[249][250][251]
Sertésekbenszerkesztés
A sertésinfluenza tünetei az emberéhez hasonlók: láz, levertség, köhögés, tüsszögés, nehéz légzés és étvágytalanság.[252] Akár vetélést is okozhat. Habár többnyire nem halálos, a fogyás miatt gazdasági kárt okoz.[252] A beteg sertések három-négy hét alatt akár 12 fontot is veszíthetnek. A sertésinfluenza alkalmanként emberre is terjedhet. A 20. század közepétől megismert vírus alkalmanként embereket is megfertőzött; 2009 előtt 50 ilyen eset ismert, melyből hat halállal végződött.[253]
2009-ben a H1N1 influenza pandémiát okozott. Ez sertésinfluenza néven vált közismertté, habár nincs arra bizonyíték, hogy valóban sertésinfluenza volt-e, azaz endemikus a sertésekben, mivel emberről emberre terjedt.[254][255] Úgy találták, hogy az emberekben, madarakban, sertésekben megtalálható H1N1 influenzák rekombinációja volt.[256]
Jegyzetekszerkesztés
- ↑ a b c d e f g h i j k l m Influenza (Seasonal). World Health Organization (WHO) , 2018. november 6. 2019. november 30-i dátummal az eredetiből archiválva. (Hozzáférés: 2019. november 30.)
- ↑ a b c Brankston G, Gitterman L, Hirji Z, Lemieux C, Gardam M (2007. április 1.). „Transmission of influenza A in human beings”. The Lancet Infectious Diseases 7 (4), 257–65. o. DOI:10.1016/S1473-3099(07)70029-4. PMID 17376383.
- ↑ a b c d Key Facts About Influenza (Flu). Centers for Disease Control and Prevention (CDC), 2014. szeptember 9. 2014. december 2-i dátummal az eredetiből archiválva. (Hozzáférés: 2014. november 26.)
- ↑ Canadian Pediatric Society (2005. október 1.). „Influenza in children”. Paediatrics & Child Health 10 (8), 485–7. o. DOI:10.1093/pch/10.8.485. PMID 19668662. [halott link]
- ↑ Paul G. Duben-Engelkirk, Janet Engelkirk. Burton's microbiology for the health sciences, 9th, Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, 314. o. (2011. április 30.). ISBN 978-1-60547-673-5
- ↑ a b c d Longo, Dan L.. Chapter 187: Influenza, Harrison's principles of internal medicine, 18th, New York: McGraw-Hill (2012). ISBN 978-0-07-174889-6
- ↑ a b Types of Influenza Viruses Seasonal Influenza (Flu). Centers for Disease Control and Prevention (CDC) , 2017. szeptember 27. (Hozzáférés: 2018. szeptember 28.)
- ↑ a b c d Su S, Fu X, Li G, Kerlin F, Veit M (2017. augusztus 25.). „Novel Influenza D virus: Epidemiology, pathology, evolution and biological characteristics”. Virulence 8 (8), 1580–91. o. DOI:10.1080/21505594.2017.1365216. PMID 28812422.
- ↑ Jefferson T, Del Mar CB, Dooley L, Ferroni E, Al-Ansary LA, Bawazeer GA, van Driel ML, Nair S, Jones MA, Thorning S, Conly JM (2011. július 1.). „Physical interventions to interrupt or reduce the spread of respiratory viruses”. Cochrane Database of Systematic Reviews (7), CD006207. o. DOI:10.1002/14651858.CD006207.pub4. PMID 21735402.
- ↑ a b Grohskopf LA, Alyanak E, Broder KR, Walter EB, Fry AM, Jernigan DB (2019). „Prevention and Control of Seasonal Influenza with Vaccines: Recommendations of the Advisory Committee on Immunization Practices – United States, 2019–20 Influenza Season”. Morbidity and Mortality Weekly Report (MMWR) 68 (3), 1–21. o, Kiadó: Centers for Disease Control and Prevention (CDC). DOI:10.15585/mmwr.rr6803a1. PMID 31441906.
- ↑ a b c Michiels B, Van Puyenbroeck K, Verhoeven V, Vermeire E, Coenen S (2013). „The value of neuraminidase inhibitors for the prevention and treatment of seasonal influenza: a systematic review of systematic reviews”. PLOS One 8 (4), e60348. o, Kiadó: Public Library of Science. DOI:10.1371/journal.pone.0060348. PMID 23565231. bibcode:2013PLoSO...860348M.
- ↑ a b Ebell MH, Call M, Shinholser J (2013. április 1.). „Effectiveness of oseltamivir in adults: a meta-analysis of published and unpublished clinical trials”. Family Practice 30 (2), 125–33. o, Kiadó: Oxford Academic. DOI:10.1093/fampra/cms059. PMID 22997224.
- ↑ a b (14 December 2017). "Up to 650 000 people die of respiratory diseases linked to seasonal flu each year". Sajtóközlemény.
- ↑ Somes MP, Turner RM, Dwyer LJ, Newall AT (2018. május 1.). „Estimating the annual attack rate of seasonal influenza among unvaccinated individuals: A systematic review and meta-analysis”. Vaccine 36 (23), 3199–207. o, Kiadó: Elsevier. DOI:10.1016/j.vaccine.2018.04.063. PMID 29716771.
- ↑ a b Spreeuwenberg P, Kroneman M, Paget J (2018. december 1.). „Reassessing the Global Mortality Burden of the 1918 Influenza Pandemic”. American Journal of Epidemiology 187 (12), 2561–67. o, Kiadó: Oxford Academic. DOI:10.1093/aje/kwy191. PMID 30202996.
- ↑ WHO (2005. december 1.). „Ten things you need to know about pandemic influenza (update of 14 October 2005)”. The Weekly Epidemiological Record (WER) 80 (49–50), 428–31. o. PMID 16372665.
- ↑ Jilani TN, Jamil RT, Siddiqui AH: H1N1 Influenza (Swine Flu). StatPearls, 2020. január 1.
- ↑ Chan, Margaret: World now at the start of 2009 influenza pandemic. World Health Organization (WHO), 2009. június 11. 2009. június 12-i dátummal az eredetiből archiválva. (Hozzáférés: 2009. június 12.)
- ↑ Palmer SR. Oxford textbook of zoonoses : biology, clinical practice, and public health control, 2., Oxford u.a.: Oxford Univ. Press, 332. o. (2011). ISBN 978-0-19-857002-8
- ↑ szerk.: Kawaoka Y: Influenza Virology: Current Topics. Caister Academic Press (2006). ISBN 978-1-904455-06-6
- ↑ Hause BM, Collin EA, Liu R, Huang B, Sheng Z, Lu W, Wang D, Nelson EA, Li F (2014). „Characterization of a novel influenza virus in cattle and swine: proposal for a new genus in the Orthomyxoviridae family”. mBio 5 (2), e00031–14. o, Kiadó: American Society for Microbiology. DOI:10.1128/mBio.00031-14. PMID 24595369.
- ↑ Collin EA, Sheng Z, Lang Y, Ma W, Hause BM, Li F (2015). „Cocirculation of two distinct genetic and antigenic lineages of proposed influenza D virus in cattle”. Journal of Virology 89 (2), 1036–42. o, Kiadó: American Society for Microbiology. DOI:10.1128/JVI.02718-14. PMID 25355894.
- ↑ Ducatez MF, Pelletier C, Meyer G (2015). „Influenza D virus in cattle, France, 2011–2014”. Emerging Infectious Diseases 21 (2), 368–71. o, Kiadó: Centers for Disease Control and Prevention (CDC). DOI:10.3201/eid2102.141449. PMID 25628038.
- ↑ Song H, Qi J, Khedri Z, Diaz S, Yu H, Chen X, Varki A, Shi Y, Gao GF (2016). „An open receptor-binding cavity of hemagglutinin-esterase-fusion glycoprotein from newly-identified Influenza D Virus: Basis for its broad cell tropism”. PLOS Pathogens 12 (1), e1005411. o, Kiadó: Public Library of Science. DOI:10.1371/journal.ppat.1005411. PMID 26816272.
- ↑ Sheng Z, Ran Z, Wang D, Hoppe AD, Simonson R, Chakravarty S, Hause BM, Li F (2014). „Genomic and evolutionary characterization of a novel influenza-C-like virus from swine”. Archives of Virology 159 (2), 249–55. o, Kiadó: Springer Science. DOI:10.1007/s00705-013-1815-3. PMID 23942954.
- ↑ Quast M, Sreenivasan C, Sexton G, Nedland H, Singrey A, Fawcett L, Miller G, Lauer D, Voss S, Pollock S, Cunha CW, Christopher-Hennings J, Nelson E, Li F (2015). „Serological evidence for the presence of influenza D virus in small ruminants”. Veterinary Microbiology 180 (3–4), 281–85. o, Kiadó: Elsevier. DOI:10.1016/j.vetmic.2015.09.005. PMID 26414999.
- ↑ Smith DB, Gaunt ER, Digard P, Templeton K, Simmonds P (2016). „Detection of influenza C virus but not influenza D virus in Scottish respiratory samples”. Journal of Clinical Virology 74, 50–53. o, Kiadó: Elsevier. DOI:10.1016/j.jcv.2015.11.036. PMID 26655269.
- ↑ Vainionpää R, Hyypiä T (1994. április 1.). „Biology of parainfluenza viruses”. Clinical Microbiology Reviews 7 (2), 265–75. o, Kiadó: American Society for Microbiology. DOI:10.1128/CMR.7.2.265. PMID 8055470.
- ↑ Hall CB (2001. június 1.). „Respiratory syncytial virus and parainfluenza virus”. The New England Journal of Medicine 344 (25), 1917–28. o, Kiadó: Massachusetts Medical Society. DOI:10.1056/NEJM200106213442507. PMID 11419430.
- ↑ Hans-Dieter Klenk, Mikhail Matrosovich, Jürgen Stech. Avian Influenza: Molecular Mechanisms of Pathogenesis and Host Range, Animal Viruses: Molecular Biology. Caister Academic Press (2008). ISBN 978-1-904455-22-6
- ↑ WHO (2006. június 30.). „Epidemiology of WHO-confirmed human cases of avian influenza A(H5N1) infection”. The Weekly Epidemiological Record (WER) 81 (26), 249–57. o. PMID 16812929.
- ↑ WHO (2008. november 1.). „Update: WHO-confirmed human cases of avian influenza A (H5N1) infection, November 2003-May 2008”. The Weekly Epidemiological Record (WER) 83 (46), 415–20. o. PMID 19009716.
- ↑ Fouchier RA, Schneeberger PM, Rozendaal FW, Broekman JM, Kemink SA, Munster V, Kuiken T, Rimmelzwaan GF, Schutten M, Van Doornum GJ, Koch G, Bosman A, Koopmans M, Osterhaus AD (2004. február 1.). „Avian influenza A virus (H7N7) associated with human conjunctivitis and a fatal case of acute respiratory distress syndrome”. Proceedings of the National Academy of Sciences of the United States of America 101 (5), 1356–61. o, Kiadó: PNAS. DOI:10.1073/pnas.0308352100. PMID 14745020. bibcode:2004PNAS..101.1356F.
- ↑ Asian Lineage Avian Influenza A(H7N9) Virus. Centers for Disease Control and Prevention (CDC), 2018. december 7. (Hozzáférés: 2019. július 10.)
- ↑ Yuan J, Zhang L, Kan X, Jiang L, Yang J, Guo Z, Ren Q (2013. november 1.). „Origin and Molecular Characteristics of a Novel 2013 Avian Influenza A(H6N1) Virus Causing Human Infection in Taiwan”. Clinical Infectious Diseases 57 (9), 1367–68. o. DOI:10.1093/cid/cit479. ISSN 1537-6591. PMID 23881153.
- ↑ a b c Hay AJ, Gregory V, Douglas AR, Lin YP (2001. december 1.). „The evolution of human influenza viruses”. Philosophical Transactions of the Royal Society of London (Series B), Biological Sciences 356 (1416), 1861–70. o, Kiadó: Royal Society. DOI:10.1098/rstb.2001.0999. PMID 11779385.
- ↑ Jakeman KJ, Tisdale M, Russell S, Leone A, Sweet C (1994. augusztus 1.). „Efficacy of 2'-deoxy-2'-fluororibosides against influenza A and B viruses in ferrets”. Antimicrobial Agents and Chemotherapy 38 (8), 1864–67. o. DOI:10.1128/aac.38.8.1864. PMID 7986023.
- ↑ Osterhaus AD, Rimmelzwaan GF, Martina BE, Bestebroer TM, Fouchier RA (2000. május 1.). „Influenza B virus in seals”. Science 288 (5468), 1051–53. o. DOI:10.1126/science.288.5468.1051. PMID 10807575. bibcode:2000Sci...288.1051O.
- ↑ Nobusawa E, Sato K (2006. április 1.). „Comparison of the mutation rates of human influenza A and B viruses”. Journal of Virology 80 (7), 3675–78. o. DOI:10.1128/JVI.80.7.3675-3678.2006. PMID 16537638.
- ↑ a b c d Webster RG, Bean WJ, Gorman OT, Chambers TM, Kawaoka Y (1992. március 1.). „Evolution and ecology of influenza A viruses”. Microbiological Reviews 56 (1), 152–79. o. DOI:10.1128/MMBR.56.1.152-179.1992. PMID 1579108.
- ↑ Zambon MC (1999. november 1.). „Epidemiology and pathogenesis of influenza”. The Journal of Antimicrobial Chemotherapy 44 Suppl B (90002), 3–9. o. DOI:10.1093/jac/44.suppl_2.3. PMID 10877456.
- ↑ Matsuzaki Y, Katsushima N, Nagai Y, Shoji M, Itagaki T, Sakamoto M, Kitaoka S, Mizuta K, Nishimura H (2006. május 1.). „Clinical features of influenza C virus infection in children”. The Journal of Infectious Diseases 193 (9), 1229–35. o. DOI:10.1086/502973. PMID 16586359.
- ↑ Katagiri S, Ohizumi A, Homma M (1983. július 1.). „An outbreak of type C influenza in a children's home”. The Journal of Infectious Diseases 148 (1), 51–56. o. DOI:10.1093/infdis/148.1.51. PMID 6309999.
- ↑ Matsuzaki Y, Sugawara K, Mizuta K, Tsuchiya E, Muraki Y, Hongo S, Suzuki H, Nakamura K (2002. február 1.). „Antigenic and genetic characterization of influenza C viruses which caused two outbreaks in Yamagata City, Japan, in 1996 and 1998”. Journal of Clinical Microbiology 40 (2), 422–29. o. DOI:10.1128/JCM.40.2.422-429.2002. PMID 11825952.
- ↑ a b Taubenberger JK, Morens DM (2008). „The pathology of influenza virus infections”. Annual Review of Pathology 3, 499–522. o. DOI:10.1146/annurev.pathmechdis.3.121806.154316. PMID 18039138.
- ↑ International Committee on Taxonomy of Viruses descriptions of:Orthomyxoviridae, Influenzavirus B and Influenzavirus C
- ↑ Nakatsu S, Murakami S, Shindo K, Horimoto T, Sagara H, Noda T, Kawaoka Y (2018. március 1.). „Influenza C and D Viruses Package Eight Organized Ribonucleoprotein Complexes”. Journal of Virology 92 (6), e02084–17. o. DOI:10.1128/jvi.02084-17. PMID 29321324.
- ↑ a b c Bouvier NM, Palese P (2008. szeptember 1.). „The biology of influenza viruses”. Vaccine 26 Suppl 4, D49–53. o. DOI:10.1016/j.vaccine.2008.07.039. PMID 19230160.
- ↑ Ghedin E, Sengamalay NA, Shumway M, Zaborsky J, Feldblyum T, Subbu V, Spiro DJ, Sitz J, Koo H, Bolotov P, Dernovoy D, Tatusova T, Bao Y, St George K, Taylor J, Lipman DJ, Fraser CM, Taubenberger JK, Salzberg SL (2005. október 1.). „Large-scale sequencing of human influenza reveals the dynamic nature of viral genome evolution”. Nature 437 (7062), 1162–66. o. DOI:10.1038/nature04239. PMID 16208317. bibcode:2005Natur.437.1162G.
- ↑ Suzuki Y (2005. március 1.). „Sialobiology of influenza: molecular mechanism of host range variation of influenza viruses”. Biological & Pharmaceutical Bulletin 28 (3), 399–408. o, Kiadó: Pharmaceutical Society of Japan. DOI:10.1248/bpb.28.399. PMID 15744059.
- ↑ a b c d Hilleman MR (2002. augusztus 1.). „Realities and enigmas of human viral influenza: pathogenesis, epidemiology and control”. Vaccine 20 (25–26), 3068–87. o. DOI:10.1016/s0264-410x(02)00254-2. PMID 12163258.
- ↑ Tong S, Zhu X, Li Y, Shi M, Zhang J, Bourgeois M, Yang H, Chen X, Recuenco S, Gomez J, et al. (2013. október 10.). „New world bats harbor diverse influenza A viruses”. PLOS Pathogens 9 (10), e1003657. o, Kiadó: Public Library of Science. DOI:10.1371/journal.ppat.1003657. PMID 24130481.
- ↑ Tong S, Li Y, Rivailler P, Conrardy C, Castillo DA, Chen LM, Recuenco S, Ellison JA, Davis CT, York IA, et al. (2012. március 1.). „A distinct lineage of influenza A virus from bats”. Proceedings of the National Academy of Sciences of the United States of America 109 (11), 4269–74. o. DOI:10.1073/pnas.1116200109. PMID 22371588. bibcode:2012PNAS..109.4269T.
- ↑ Smith AE, Helenius A (2004. április 1.). „How viruses enter animal cells”. Science 304 (5668), 237–42. o. DOI:10.1126/science.1094823. PMID 15073366. bibcode:2004Sci...304..237S.
- ↑ a b Wagner R, Matrosovich M, Klenk HD (May–June 2002). „Functional balance between haemagglutinin and neuraminidase in influenza virus infections”. Reviews in Medical Virology 12 (3), 159–66. o, Kiadó: Wiley-Blackwell. DOI:10.1002/rmv.352. PMID 11987141.
- ↑ a b Steinhauer DA (1999. május 1.). „Role of hemagglutinin cleavage for the pathogenicity of influenza virus”. Virology 258 (1), 1–20. o. DOI:10.1006/viro.1999.9716. PMID 10329563.
- ↑ Liu SL, Zhang ZL, Tian ZQ, Zhao HS, Liu H, Sun EZ, Xiao GF, Zhang W, Wang HZ, Pang DW (2011) Effectively and efficiently dissecting the infection of influenza virus by quantum dot-based single-particle tracking. ACS Nano
- ↑ Lakadamyali M, Rust MJ, Babcock HP, Zhuang X (2003. augusztus 1.). „Visualizing infection of individual influenza viruses”. Proceedings of the National Academy of Sciences of the United States of America 100 (16), 9280–85. o. DOI:10.1073/pnas.0832269100. PMID 12883000. bibcode:2003PNAS..100.9280L.
- ↑ a b Pinto LH, Lamb RA (2006. április 1.). „The M2 proton channels of influenza A and B viruses”. The Journal of Biological Chemistry 281 (14), 8997–9000. o. DOI:10.1074/jbc.R500020200. PMID 16407184.
- ↑ Cros JF, Palese P (2003. szeptember 1.). „Trafficking of viral genomic RNA into and out of the nucleus: influenza, Thogoto and Borna disease viruses”. Virus Research 95 (1–2), 3–12. o. DOI:10.1016/S0168-1702(03)00159-X. PMID 12921991.
- ↑ Kash JC, Goodman AG, Korth MJ, Katze MG (2006. július 1.). „Hijacking of the host-cell response and translational control during influenza virus infection”. Virus Research 119 (1), 111–20. o, Kiadó: Elsevier. DOI:10.1016/j.virusres.2005.10.013. PMID 16630668.
- ↑ Nayak DP, Hui EK, Barman S (2004. december 1.). „Assembly and budding of influenza virus”. Virus Research 106 (2), 147–65. o, Kiadó: Elsevier. DOI:10.1016/j.virusres.2004.08.012. PMID 15567494.
- ↑ Drake JW (1993. május 1.). „Rates of spontaneous mutation among RNA viruses”. Proceedings of the National Academy of Sciences of the United States of America 90 (9), 4171–75. o. DOI:10.1073/pnas.90.9.4171. PMID 8387212. bibcode:1993PNAS...90.4171D.
- ↑ He CQ, Xie ZX, Han GZ, Dong JB, Wang D, Liu JB, Ma LY, Tang XF, Liu XP, Pang YS, Li GR (2009. január 1.). „Homologous recombination as an evolutionary force in the avian influenza A virus”. Molecular Biology and Evolution 26 (1), 177–87. o, Kiadó: Oxford Academic. DOI:10.1093/molbev/msn238. PMID 18931384.
- ↑ De A, Sarkar T, Nandy A (2016). „Bioinformatics studies of Influenza A hemagglutinin sequence data indicate recombination-like events leading to segment exchanges”. BMC Research Notes 9, 222. o, Kiadó: Springer Nature. DOI:10.1186/s13104-016-2017-3. PMID 27083561.
- ↑ Flu Symptoms & Diagnosis. Centers for Disease Control and Prevention (CDC) , 2019. július 10. (Hozzáférés: 2020. január 24.)
- ↑ Flu Symptoms & Complications. Centers for Disease Control and Prevention (CDC), 2019. február 26. (Hozzáférés: 2019. július 6.)
- ↑ a b Call SA, Vollenweider MA, Hornung CA, Simel DL, McKinney WP (2005. február 1.). „Does this patient have influenza?”. JAMA 293 (8), 987–97. o, Kiadó: American Medical Association (United States). DOI:10.1001/jama.293.8.987. PMID 15728170.
- ↑ a b c d Carrat F, Vergu E, Ferguson NM, Lemaitre M, Cauchemez S, Leach S, Valleron AJ (2008. április 1.). „Time lines of infection and disease in human influenza: a review of volunteer challenge studies”. American Journal of Epidemiology 167 (7), 775–85. o. DOI:10.1093/aje/kwm375. ISSN 1476-6256. PMID 18230677. „In almost all studies, participants were individually confined for 1 week”
- ↑ See especially Figure 5 mutatja, hogy a fertőzőképesség a második napon, míg a tünetek erőssége a harmadik napon éri el a csúcsot
- ↑ Suzuki E, Ichihara K, Johnson AM (2007. január 1.). „Natural course of fever during influenza virus infection in children”. Clinical Pediatrics 46 (1), 76–79. o, Kiadó: SAGE. DOI:10.1177/0009922806289588. PMID 17164515.
- ↑ a b Tesini, Brenda L.: Influenza (Flu). Merck, 2018. szeptember 1. 2008. március 17-i dátummal az eredetiből archiválva. (Hozzáférés: 2008. március 15.)
- ↑ Richards S (2005). „Flu blues”. Nursing Standard 20 (8), 26–7. o, Kiadó: Royal College of Nursing. DOI:10.7748/ns.20.8.26.s29. PMID 16295596.
- ↑ Heikkinen T (2006. július 1.). „Influenza in children”. Acta Paediatrica 95 (7), 778–84. o. DOI:10.1080/08035250600612272. PMID 16801171.
- ↑ Kerr AA, McQuillin J, Downham MA, Gardner PS (1975. február 1.). „Gastric 'flu influenza B causing abdominal symptoms in children”. The Lancet 1 (7902), 291–5. o, Kiadó: Elsevier. DOI:10.1016/S0140-6736(75)91205-2. PMID 46444.
- ↑ a b Eccles R (2005. november 1.). „Understanding the symptoms of the common cold and influenza”. The Lancet Infectious Diseases 5 (11), 718–25. o. DOI:10.1016/S1473-3099(05)70270-X. PMID 16253889.
- ↑ Hui DS (2008. március 1.). „Review of clinical symptoms and spectrum in humans with influenza A/H5N1 infection”. Respirology 13 Suppl 1, S10-3. o, Kiadó: Wiley /Asian Pacific Society of Respirology. DOI:10.1111/j.1440-1843.2008.01247.x. PMID 18366521.
- ↑ Monto A, Gravenstein S, Elliott M, Colopy M, Schweinle J (2000). „Clinical signs and symptoms predicting influenza infection”. Archives of Internal Medicine 160 (21), 3243–47. o. DOI:10.1001/archinte.160.21.3243. PMID 11088084.
- ↑ Smith K, Roberts M (2002). „Cost-effectiveness of newer treatment strategies for influenza”. The American Journal of Medicine (AJM) 113 (4), 300–07. o, Kiadó: Alliance for Academic Internal Medicine. DOI:10.1016/S0002-9343(02)01222-6. PMID 12361816.
- ↑ a b c Rothberg M, Bellantonio S, Rose D (2003. szeptember 2.). „Management of influenza in adults older than 65 years of age: cost-effectiveness of rapid testing and antiviral therapy”. Annals of Internal Medicine 139 (5 Pt 1), 321–29. o, Kiadó: American College of Physicians (ACP). DOI:10.7326/0003-4819-139-5_part_1-200309020-00007. PMID 12965940.
- ↑ Information for Clinicians on Influenza Virus Testing. Centers for Disease Control and Prevention (CDC), 2018. február 26. 2009. május 3-i dátummal az eredetiből archiválva. (Hozzáférés: 2009. május 1.)
- ↑ Rapid Diagnostic Testing for Influenza: Information for Clinical Laboratory Directors. Centers for Disease Control and Prevention (CDC), 2015. október 13. 2016. január 16-i dátummal az eredetiből archiválva. (Hozzáférés: 2016. február 2.)
- ↑ Jain S, Kamimoto L, Bramley AM, Schmitz AM, Benoit SR, Louie J, Sugerman DE, Druckenmiller JK, Ritger KA, Chugh R, Jasuja S, Deutscher M, Chen S, Walker JD, Duchin JS, Lett S, Soliva S, Wells EV, Swerdlow D, Uyeki TM, Fiore AE, Olsen SJ, Fry AM, Bridges CB, Finelli L, (2009 Pandemic Influenza A 'H1N1' Virus Hospitalizations Investigation Team) (2009. november 1.). „Hospitalized Patients with 2009 H1N1 Influenza in the United States, April–June 2009”. New England Journal of Medicine 361 (20), 1935–44. o. DOI:10.1056/nejmoa0906695. ISSN 0028-4793. PMID 19815859. citeseerx:10.1.1.183.7888.
- ↑ Transcript of virtual press conference with Gregory Hartl, Spokesperson for H1N1, and Dr Nikki Shindo, Medical Officer, Global Influenza Programme, World Health Organization. World Health Organization (WHO), 2009. november 12. 2009. november 29-i dátummal az eredetiből archiválva.
- ↑ Grady, Denise. „Report Finds Swine Flu Has Killed 36 Children”, The New York Times, 2009. szeptember 3.. 2017. június 27-i dátummal az eredetiből archiválva
- ↑ a b Guide for considering influenza testing when influenza viruses are circulating in the community. Centers for Disease Control and Prevention (CDC), 2018. február 20. (Hozzáférés: 2018. március 30.)
- ↑ a b The Flu: What To Do If You Get Sick. Centers for Disease Control and Prevention (CDC) , 2019. október 8. (Hozzáférés: 2020. január 24.)
- ↑ Sherman, Irwin W.. Twelve diseases that changed our world. Washington, DC: ASM Press, 161. o. (2007). ISBN 978-1-55581-466-3
- ↑ Mitamura K, Sugaya N (2006. június 1.). „Diagnosis and Treatment of influenza – clinical investigation on viral shedding in children with influenza”. Uirusu (Journal of virology) 56 (1), 109–16. o, Kiadó: Society for Virology (Japan). DOI:10.2222/jsv.56.109. PMID 17038819.
- ↑ Gooskens J, Jonges M, Claas EC, Meijer A, Kroes AC (2009. május 1.). „Prolonged influenza virus infection during lymphocytopenia and frequent detection of drug-resistant viruses”. The Journal of Infectious Diseases 199 (10), 1435–41. o. DOI:10.1086/598684. PMID 19392620.
- ↑ a b c d e Weber TP, Stilianakis NI (2008. november 1.). „Inactivation of influenza A viruses in the environment and modes of transmission: a critical review”. The Journal of Infection 57 (5), 361–73. o. DOI:10.1016/j.jinf.2008.08.013. PMID 18848358.
- ↑ Hall CB (2007. augusztus 1.). „The spread of influenza and other respiratory viruses: complexities and conjectures”. Clinical Infectious Diseases 45 (3), 353–59. o, Kiadó: Oxford Academic. DOI:10.1086/519433. PMID 17599315.
- ↑ Cole EC, Cook CE (1998. augusztus 1.). „Characterization of infectious aerosols in health care facilities: an aid to effective engineering controls and preventive strategies”. American Journal of Infection Control 26 (4), 453–64. o. DOI:10.1016/S0196-6553(98)70046-X. PMID 9721404.
- ↑ Kormuth KA, Lin K, Prussin AJ, Vejerano EP, Tiwari AJ, Cox SS, Myerburg MM, Lakdawala SS, Marr LC (2018. július 1.). „Influenza Virus Infectivity Is Retained in Aerosols and Droplets Independent of Relative Humidity”. The Journal of Infectious Diseases 218 (5), 739–747. o. DOI:10.1093/infdis/jiy221. PMID 29878137.
- ↑ a b Thomas Y, Vogel G, Wunderli W, Suter P, Witschi M, Koch D, Tapparel C, Kaiser L (2008. május 1.). „Survival of influenza virus on banknotes”. Applied and Environmental Microbiology 74 (10), 3002–07. o. DOI:10.1128/AEM.00076-08. PMID 18359825.
- ↑ Bean B, Moore BM, Sterner B, Peterson LR, Gerding DN, Balfour HH (1982. július 1.). „Survival of influenza viruses on environmental surfaces”. The Journal of Infectious Diseases 146 (1), 47–51. o. DOI:10.1093/infdis/146.1.47. PMID 6282993.
- ↑ a b Influenza Factsheet. Center for Food Security and Public Health, Iowa State University. 2009. március 23-i dátummal az eredetiből archiválva. p. 7
- ↑ Jefferies WM, Turner JC, Lobo M, Gwaltney JM (1998. március 1.). „Low plasma levels of adrenocorticotropic hormone in patients with acute influenza”. Clinical Infectious Diseases 26 (3), 708–10. o, Kiadó: Oxford Academic. DOI:10.1086/514594. PMID 9524849.
- ↑ a b Korteweg C, Gu J (2008. május 1.). „Pathology, molecular biology, and pathogenesis of avian influenza A (H5N1) infection in humans”. The American Journal of Pathology 172 (5), 1155–70. o. DOI:10.2353/ajpath.2008.070791. PMID 18403604.
- ↑ Nicholls JM, Chan RW, Russell RJ, Air GM, Peiris JS (2008. április 1.). „Evolving complexities of influenza virus and its receptors”. Trends in Microbiology 16 (4), 149–57. o. DOI:10.1016/j.tim.2008.01.008. PMID 18375125.
- ↑ van Riel D, Munster VJ, de Wit E, Rimmelzwaan GF, Fouchier RA, Osterhaus AD, Kuiken T (2006. április 1.). „H5N1 Virus Attachment to Lower Respiratory Tract”. Science 312 (5772), 399. o. DOI:10.1126/science.1125548. PMID 16556800.
- ↑ van Riel D, Munster VJ, de Wit E, Rimmelzwaan GF, Fouchier RA, Osterhaus AD, Kuiken T (2006. április 1.). „H5N1 Virus Attachment to Lower Respiratory Tract”. Science 312 (5772), 399. o. DOI:10.1126/science.1125548. PMID 16556800.
- ↑ Shinya K, Ebina M, Yamada S, Ono M, Kasai N, Kawaoka Y (2006. március 1.). „Avian flu: influenza virus receptors in the human airway”. Nature 440 (7083), 435–36. o. DOI:10.1038/440435a. PMID 16554799. bibcode:2006Natur.440..435S.
- ↑ van Riel D, Munster VJ, de Wit E, Rimmelzwaan GF, Fouchier RA, Osterhaus AD, Kuiken T (2007. október 1.). „Human and avian influenza viruses target different cells in the lower respiratory tract of humans and other mammals”. The American Journal of Pathology 171 (4), 1215–23. o. DOI:10.2353/ajpath.2007.070248. PMID 17717141.
- ↑ Schmitz N, Kurrer M, Bachmann MF, Kopf M (2005. május 1.). „Interleukin-1 is responsible for acute lung immunopathology but increases survival of respiratory influenza virus infection”. Journal of Virology 79 (10), 6441–48. o. DOI:10.1128/JVI.79.10.6441-6448.2005. PMID 15858027.
- ↑ Winther B, Gwaltney JM, Mygind N, Hendley JO (1998). „Viral-induced rhinitis”. American Journal of Rhinology 12 (1), 17–20. o. DOI:10.2500/105065898782102954. PMID 9513654.
- ↑ Beigel J, Bray M (2008. április 1.). „Current and future antiviral therapy of severe seasonal and avian influenza”. Antiviral Research 78 (1), 91–102. o. DOI:10.1016/j.antiviral.2008.01.003. PMID 18328578.
- ↑ Stephen G. Spiro, Gerard A. Silvestri, Alvar Agustí. Clinical Respiratory Medicine. Elsevier Health Sciences, 311. o. (2012). ISBN 978-1-4557-2329-4
- ↑ Influenza Virus Testing Methods. Centers for Disease Control and Prevention (CDC), 2018. március 26. (Hozzáférés: 2018. március 30.)
- ↑ a b „Wash your hands often and right way”, Centers for Disease Control and Prevention (CDC), 2018. január 5. (Hozzáférés: 2018. március 29.)
- ↑ a b Flu: MedlinePlus Medical Encyclopedia. U.S. National Library of Medicine. 2010. február 14-i dátummal az eredetiből archiválva. (Hozzáférés: 2010. február 7.)
- ↑ A WHO „visszafokozta” az oszeltamivires influenza elleni gyógyszert. pharmaonline.hu, 2017. július 28. (Hozzáférés: 2020. február 4.)
- ↑ Stephenson I, Nicholson KG (1999. július 1.). „Chemotherapeutic control of influenza”. The Journal of Antimicrobial Chemotherapy 44 (1), 6–10. o. DOI:10.1093/jac/44.1.6. PMID 10459804.
- ↑ Most popular antiviral medication brands in the Russian pharmaceutical market in 1st quarter 2020 by sales value share. Statista . (Hozzáférés: 2020. június 17.)
- ↑ Moscona A (2009. március 5.). „Global Transmission of Oseltamivir-Resistant Influenza”. New England Journal of Medicine 360 (10), 953–56. o. DOI:10.1056/NEJMp0900648. ISSN 0028-4793. PMID 19258250.
- ↑ (2006. január 1.) „High levels of adamantane resistance among influenza A (H3N2) viruses and interim guidelines for use of antiviral agents – United States, 2005–06 influenza season”. Morbidity and Mortality Weekly Report (MMWR) 55 (2), 44–46. o, Kiadó: Centers for Disease Control and Prevention (CDC). PMID 16424859.
- ↑ Bright RA, Medina MJ, Xu X, Perez-Oronoz G, Wallis TR, Davis XM, Povinelli L, Cox NJ, Klimov AI (2005. október 1.). „Incidence of adamantane resistance among influenza A (H3N2) viruses isolated worldwide from 1994 to 2005: a cause for concern”. The Lancet 366 (9492), 1175–81. o. DOI:10.1016/S0140-6736(05)67338-2. PMID 16198766.
- ↑ Ilyushina NA, Govorkova EA, Webster RG (2005. október 1.). „Detection of amantadine-resistant variants among avian influenza viruses isolated in North America and Asia”. Virology 341 (1), 102–06. o. 2013. november 3-i dátummal az eredetiből archiválva. DOI:10.1016/j.virol.2005.07.003. PMID 16081121. (Hozzáférés: 2020. augusztus 7.)
- ↑ Parry J (2005. július 1.). „Use of antiviral drug in poultry is blamed for drug resistant strains of avian flu”. BMJ (British Medical Journal) 331 (7507), 10. o, Kiadó: British Medical Association. DOI:10.1136/bmj.331.7507.10. PMID 15994677.
- ↑ Glasgow JF, Middleton B (2001. november 1.). „Reye syndrome – insights on causation and prognosis”. Archives of Disease in Childhood 85 (5), 351–53. o. DOI:10.1136/adc.85.5.351. PMID 11668090. Információ forrás: https://hu.wikipedia.org/wiki/Influenza
A lap szövege Creative Commons Nevezd meg! – Így add tovább! 3.0 licenc alatt van; egyes esetekben más módon is felhasználható. Részletekért lásd a felhasználási feltételeket.
Analóg multiméterek túlterhelés elleni védelme
Egyenáram
Egyenáram mérése
Egyenirányítós lengőtekercses műszer
Elektromágnes (fizika)
Elektromos feszültség
Elektromos térerősség
Fáziseltolódás
Fázismutató
Fajlagos ellenállás
Feszültséggenerátor
Feszültségváltó
Forgó mágneses tér
Háromfázisú hálózat
Hőelektromosság
Hatásos ellenállás
A lap szövege Creative Commons Nevezd meg! – Így add tovább! 3.0 licenc alatt van; egyes esetekben más módon is felhasználható. Részletekért lásd a felhasználási feltételeket.
