

A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
A pH (pondus hidrogenii, latinul potentia hydrogeni, hidrogénion-kitevő) dimenzió nélküli kémiai mennyiség, mely egy adott oldat kémhatását (savasságát vagy lúgosságát) jellemzi. Híg vizes oldatokban a pH egyenlő az oxóniumion-koncentráció tízes alapú logaritmusának ellentettjével.
vagy egyszerűbben:
(A hidrogénion (H+) a víz autoprotolízisével, vagy a savak ionizációjával keletkezik, de vizes közegben mindig hozzákapcsolódik egy vízmolekulához, és oxóniumion (H3O+) jön létre.)
A víz autoprotolízise, pH
A víz autoprotolízise olyan egyensúlyi reakció, melynek során 10−7 mólnyi vízmolekula ad át protont egy másiknak (1 liter vízben, 25 °C-on):
- Erre az egyensúlyi reakcióra felírható a Kvíz egyensúlyi állandó:
- Kvíz = = 10−7mol/dm³ · 10−7mol/dm³ = 10−14(mol/dm³)²
- A szögletes zárójellel a megfelelő ionok moláris koncentrációját jelöljük, ennek szokásos mértékegysége: mol/dm³; az SI-mértékegység ezerszerese. 1 dm³ = 1 liter.
- Ebből következik:
- tiszta vízben és semleges kémhatású oldatokban:
- = = 10−7 mol/dm³
- pH = −lg10−7 = 7
- Savak és lúgok híg vizes oldatában az egyensúly eltolódik, de a kétféle ion moláris koncentrációjának szorzata (Kvíz) állandó marad:
- savas közegben megnő az oxóniumionok moláris koncentrációja:
- - például egy erős savból készült 0,1 mol/dm³ koncentrációjú oldatban (25 °C-on):
- = 10−1 mol/dm³
- = 10−13 mol/dm³
- pH = −lg = −lg10−1 = 1
- tehát H3O+ > OH−, vagyis H3O+ > 10−7 mol/dm³.
- pH < 7
- Savak és lúgok híg vizes oldatában az egyensúly eltolódik, de a kétféle ion moláris koncentrációjának szorzata (Kvíz) állandó marad:
- lúgos közegben lecsökken az oxóniumionok moláris koncentrációja:
- - például egy erős lúgból készült 0,1 mol/dm³ koncentrációjú oldatban (25 °C-on):
- H3O+ = 10−13 mol/dm³
- OH− = 10−1 mol/dm³
- pH = −lgH3O+ = −lg10−13 = 13
- tehát H3O+ < OH−, vagyis H3O+ < 10−7 mol/dm³.
- pH > 7
Összefoglalva: A tiszta víz pH-értéke 7, ennél kisebb pH-érték savasságot, nagyobb pH-érték pedig lúgosságot jelez.
Ugyanilyen gondolatmenet szerint ki lehet számítani a pOH-t is. Ennek változása ellentétes a pH változásával.
pH-értékekszerkesztés
| Anyag | pH-érték | savas |
|---|---|---|
| Akkumulátorsav (kénsav): H2SO4 | 0-0,5 | |
| Sósav (gyomorsav - üres gyomor) | 1,0–1,5 | |
| Citromsav | 2,4 | |
| Coca-Cola | 2,0–3,0 | |
| Ecetsav | 2,5 | |
| Gyümölcslé (meggy) | 2,7 | |
| Narancslé és almalé | 3,5 | |
| Bor | 4 | |
| Savanyú tej | 4,5 | |
| Sör | 4,5–5,0 | |
| Savas eső | < 5,0 | |
| Kávé | 5,0 | |
| Tea | 5,5 | |
| Eső | 5,6 | |
| Ásványvíz | 6,0 | |
| Tej | 6,5 | semleges |
| Víz (a víz keménységétől függően) | 6,0–8,5 | |
| Emberi nyál | 6,5–7,4 | |
| Vér | 7,4 | lúgos |
| Tengervíz | 7,5–8,4 | |
| Hasnyálmirigy-váladék (bél) | 8,3 | |
| Szappan | 9,0–10,0 | |
| Háztartási ammónia | 11,5 | |
| Oltott mész - Ca(OH)2 | 12,4 | |
| Hipó - fehérítő | 12,5 | |
| Beton | 12,6 | |
| Marónátron - NaOH | 13,5–14 |
pH-mérésszerkesztés
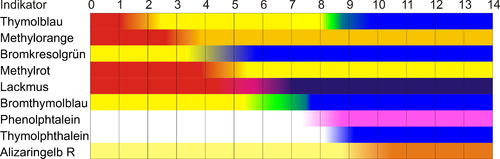
A pH értéket indikátorokkal, vagy digitális pH-mérőkkel lehet meghatározni:
 |
 |
 |
 |
 |
Pontos definíciószerkesztés
A pH-ra a fenti képlet csak híg vizes oldatokban igaz. A pH valójában a hidrogénion-aktivitástól függ, ami töményebb oldatokban nem egyenlő a hidrogénion-koncentrációval. Tömény oldatok esetén a pH-t a hidrogénion-aktivitás segítségével fejezzük ki:
A képletben a hidrogénion-aktivitás. A hidrogénion-aktivitást a koncentrációból az aktivitási együttható (, vagy ) segítségével kaphatjuk meg. Az aktivitási együttható egy 0 és 1 közé eső viszonyszám, mely számos tényezőtől, köztük a hidrogénion-koncentrációtól függ.
Kis hidrogénion-koncentráció mellett az aktivitási együttható magas, értéke jó közelítéssel 1. Így híg oldatban a hidrogénion-koncentráció megegyezik a hidrogénion-aktivitással. A pH tehát közvetlenül számolható a koncentrációból.
A pH mértékegységérőlszerkesztés
A fenti képletek az ún. szabványos koncentráció mértékegységét tartalmazzák, amely az SI-egységnek ezredrésze: mol/dm³. Ebben további ellentmondás, hogy a koncentrációnál a nevezőben az egész oldat térfogata áll, míg a molalitásnál csak az oldószer tömege kerül a nevezőbe. A Green Book második kiadása egyenértékűként fogadta el kétféle mértékegységgel is (γ± az ionos aktivitási együttható az IUPAC dokumentumban; azonos a fent alkalmazott f jelű fizikai mennyiséggel) :
A törtvonal értelme e képletekben az, hogy a fizikai mennyiség értékét osztjuk a mértékegységével, így annak mérőszámát kapjuk. Aktuálisan ez azt jelentette, hogy a koncentráció és a molalitás mérőszáma azonos, máskülönben nem eredményezhetnének azonos pH-értéket. Ne felejtsük el azt sem, hogy a képletben nem a koncentráció SI-mértékegysége szerepel, hanem annak ezredrésze, aktuálisan: mol/dm³, ami sérti a mértékegységrendszer koherenciáját. A dokumentumok erre a problémára egy másik megoldást is adnak; definiálják a szabványos koncentráció fogalmát a következőképpen:
Analóg multiméterek túlterhelés elleni védelme
Egyenáram
Egyenáram mérése
Egyenirányítós lengőtekercses műszer
Elektromágnes (fizika)
Elektromos feszültség
Elektromos térerősség
Fáziseltolódás
Fázismutató
Fajlagos ellenállás
Feszültséggenerátor
Feszültségváltó
Forgó mágneses tér
Háromfázisú hálózat
Hőelektromosság
Hatásos ellenállás
A lap szövege Creative Commons Nevezd meg! – Így add tovább! 3.0 licenc alatt van; egyes esetekben más módon is felhasználható. Részletekért lásd a felhasználási feltételeket.













