A | B | C | D | E | F | G | H | CH | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9
A világító rúd (angolul: glow stick) egy egyszer használatos, átlátszó műanyag cső, amely egymástól elszigetelt anyagokat tartalmaz. Az anyagokat egyesítve a kemolumineszcencia következtében fény keletkezik. A világító rúd elsősorban szórakoztató eszköz, azonban használja a katonaság, a rendőrség, a tűzoltóság és a mentők is.
A világító rúdban hidrogén-peroxid és difenil-oxalát van. Ezek, ha keverednek, világítanak. Idővel a reakció alábbhagy, és a pálca elhalványodik. Ha használat előtt mélyhűtőbe teszik, hónapokig használható marad. Horgászatban is alkalmazzák. Egyszer használatos eszköz, a fény nem kapcsolgatható.
Története
A Cyalume vegyületet Michael M. Rauhut,[1] Robert W. Sombathy és Laszlo J. Bollyky amerikai kutató Edwin A. Chandross (Bell Laboratórium) és Richard D. Sokolowski (Eh.M Laboratórium) munkái alapján fedezte fel.[2][3]
Körülbelül ugyanebben az időben a China Lake Naval Weapons Centernél dolgozó Herbert Richter és csapata is foglalkozott kemilumineszcenciával.[4][5]
Az Amerikai Egyesült Államokban több szabadalmat is benyújtottak világító rúdra. Bernard Dubrow és Eugene Daniel Guth 1965 júniusában nyújtotta be szabadalmát kemilumineszcenciás csomagjáról.[6] 1973 októberében Clarence W. Gilliam, David Iba Sr. és Thomas N. Hall regisztrált, mint a kémiai világító eszköz feltalálója.[7] 1974 júniusában Herbert P. Richter és Ruth E. Tedric kemilumineszcens eszközt szabadalmaztatott.[8]
Vincent J. Esposito, Steven M. Little, és John H. Lyons 1976. november 1-jén az Egyesült Államokban jegyezte be kemilumineszcens jelzőeszközét.[9] A szabadalomban egy ampulla szerepelt, amiben az egyik, körülötte a másik anyag. Az ampulla eltörésével a két anyag keveredett, és fényt bocsátott ki. A szabadalom tartalmazott talpat is, amin a rúd meg tudott állni, ha mozgó járműből dobták ki. Ezzel képes volt helyettesíteni a hagyományosabb világító eszközöket vészhelyzetben. Előnyei: nem tűzveszélyes, használata könnyű és biztonságos, és az sem hatástalanítja, ha áthajtanak rajta. Ez a szerkezet jobban megfelel a mai világító rudak felépítésének.
1977 decemberében Richard Taylor Van Zandt kémiai világító eszközt szabadalmaztatott.[10] A terv tartalmaz egy acélgolyót, ami eltöri az ampullát, ha a rudat elég erősen megrázzák. Ha kilövik, akkor még sötétben repül, és csak becsapódáskor kezd világítani a hirtelen lassulás hatására.

Alkalmazása

A világító rúd sok célra használható, mivel vízhatlan, és nem kell hozzá áramforrás. Kevés hőt szabadít fel. Olcsó és eldobható. Nagy nyomást is elvisel, így a búvárok előszeretettel használják merüléseknél a sötétebb mederfenék közelében. Táborozások alkalmával is felbukkan. A katonai szervezeteknél is rendszeresített segédeszköz: világításra és fényjelzések adására alkalmazzák. A katasztrófavédelem számára sem ismeretlen eszköz. Földrengések, viharok, áradások esetén is használják, mert nem fogyaszt áramot, így nem áll fent a szikrázás veszélye - amely a szivárgó gáz belobbantásával további károkat okozhatna.[11]
Az elektronikus zenei rendezvények meghatározó szimbóluma, koncerteken, táncpartikon.[12] Éjszakai előadásokon az előadóművészek veszik elő; fesztiválok és ünnepségek díszítő elemei. Játékok, jól látható éjszakai jelzések a közlekedők számára. Viselhető változataik segítenek vigyázni a gyerekekre éjszaka. Fényeffektusokat hoznak létre vele ballonnal röptetve. Alkalmas fényeffektek létrehozására a kevés fényt használó fényképészet és film számára.[13]
A Guinness Rekordok Könyve szerint a világ legnagyobb világító rúdja 150 méteres volt. A Wisconsin–Whitewater Egyetem kémia tanszéke alkotta meg, hogy megünnepelje az egyetem alapításának 150 éves évfordulóját. 2018 szeptember 9-én törték el.[14]
Működése
A világító rúd azután kezd világítani, hogy két anyag összekeveredik. A reakciót katalizátor segíti, ez rendszerint nátrium-szalicilát.[15] A rudak tartalmaznak egy kis, törhető tartályt egy rugalmas külső tartállyal körülvéve. Ennek meghajlításakor a belső tartály eltörik, így az anyagok elegyednek, ami lehetővé teszi a reakciót. Eltörés után ajánlott a rudat megrázni, hogy az anyagok minél jobban elkeveredjenek.
A világító rúd tartalmaz két vegyületet, egy katalizátort és egy színezéket. Az anyagok exergonikus reakcióba lépnek egymással. A külső csőben a színezék, a katalizátor és difenil-oxalát található. A belső tartályban hidrogén-peroxid van. A hidrogén-peroxid és a difenil-oxalát észter keveredésével kémiai reakció kezdődik, melynek eredménye fenol és peroxisav-észter (1,2-dioxetándion).[16] A peroxisav spontán szén-dioxidra bomlik; az ebből keletkező energia gerjeszti a színezéket, ami ennek hatására fotont bocsát ki. A foton hullámhossza, azaz a kibocsátott fény színe a színezék szerkezetétől függ. Csak kis mértékben szabadul fel hő,[15] mivel a fordított irányú reakció, 1,2-dioxetándion fotocikloaddíciója megsérti a Woodward–Hoffmann-szabályokat, így hevítéssel nem idézhető elő.
Az összetétel beállításával a gyártó szabályozni tudja, hogy a rúd rövidebb ideig fényesen vagy hosszabb ideig halványan világítson, ezzel tudnak alkalmazkodni a különböző éghajlati körülményekhez, mivel a reakció sebessége függ a hőmérséklettől. A reagensek maximális koncentrációja esetén a rúd csak pár másodpercre villan fel a reakció hevessége miatt. Hasonló hatás érhető el a nátrium-szalicilát vagy más katalizátor mennyiségének növelésével. Melegítés hatására a reakció felgyorsul, és a rúd is fényesebb lesz; hűtés hatására tovább tart, és fényereje csökken. Ez megmutatható egy aktív világító rúddal is. A színezék ultraibolya sugárzás hatására is fluoreszkál, akkor is, ha a rúd már nem világít.
A rúd az aktiválást követő időben világít a legfényesebben, utána a fényerősség exponenciálisan csökken. Hűtéssel a gyengülés egyenletesebb.[17]
Több fluorofór is használható az oldatban vagy a rúd falában. Ennek előnye, hogy a falban lehet olyan fluorofór is, ami az oldatban lebomlana. Az első fluorofór által kibocsátott fény nagy részét a második elnyeli, és további fényt sugároz ki, rövidebb hullámhosszal. Így alakítható ultraibolya sugárzás láthatóvá, zöld narancssárgává, vagy látható fény közeli infravörössé. Az eltolódás akár 200 nm is lehet, de a kibocsátási spektrum rendszerint 20-100 nm-rel hosszabb, mint az elnyelési.[18] Az ezzel a megközelítéssel készült világító rudak tartálya színes a benne levő fluorofór miatt. Az infravörös világító rudak sötétvörösnek vagy feketének látszanak, mivel a falban levő színezék elnyeli a bent kibocsátott fény nagy részét, és közeli infravöröst sugároz ki.
Különböző fluorofórok keverésével különböző színek érhetőek el a kívánt hatáshoz.[15][19] Additív színkeveréssel további színek hozhatók létre. Például narancssárga szín elérésére piros, sárga, zöld fluorofórokat használnak;[15] fehér színt négy-öt fluorofórral állítanak elő.[19]
Fluorofórok
A következő anyagokat használják a különböző színű fények előállítására:
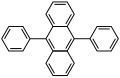
- 9,10-difenilantracén (DPA): kék
- 9-(2-feniletenil)antracén: kékeszöld
- 1-kloro-9,10-difenilantracén (1-kloro(DPA)) és 2-kloro-9,10-difenilantracén (2-kloro(DPA)): kékeszöld
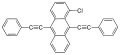
- 9,10-bisz(feniletinil)antracén (BPEA): zöld, maximumát 486 nm-nél éri el
- 1-kloro-9,10-bisz(feniletinil)antracén: sárgászöld, használják 30 perces Cyalume világító rudakban
- 2-kloro-9,10-bisz(feniletinil)antracén: zöld, használják 12 órás Cyalume világító rudakban
- 1,8-dikloro-9,10-bisz(feniletinil)antracén: sárga, használják Cyalume világító rudakban
- rubrén: narancssárga, maximuma 550 nm
- 2,4-di-tert-butilfenil-1,4,5,8-tetrakarboxinaftalén-diamid: mélyvörös, DPA-val együtt fehér és rózsaszín rudakhoz, arányuktól függően
- rodamin B: piros, de ritkán használják, mivel CPPO-val érintkezve lebomlik, megrövidítve a világító rúd aktív szakaszát
- 5,12-bisz(feniletinil)naftacén: narancssárga
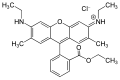
- violantrón: narancssárga, maximuma 630 nm
- 16,17-(1,2-etiléndioxi)violantrón: piros, maximuma 680 nm-nél
- 16,17-dihexiloxiviolantrón: infravörös, maximuma 725 nm-nél[20]
- 16,17-butiloxiviolantrón: infravörös[21]
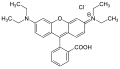
- N,N'-bisz(2,5-di-tert-butilfenil)-3,4,9,10-periléndikarboximid: piros[21]
- 1-N,N-dibutilaminoantracén: infravörös[21]
- 6-metilakridinium-jodid: infravörös[21]
Biztonság
A világító rudakban végbement reakcióban fenol keletezik, ami mérgerző. Bőrrel érintkezve az elegy irritációt, duzzanatot, extrém esetben hányingert, hányást is okozhat. A régebbi típusokban használt vegyületek egy része rákkeltő lehet, [22] ami a policiklusos aromás szénhidrogénekről már be is bizonyosodott.
A dibutil-ftalátot Kalifornia felvette a teratogéngyanús vegyületek közé 2006-ban.[23]
A világító rudak tartalma képes műanyagok elfolyósítására.[24]
A difenil-oxalát csípi és égeti a szemet, irritálja a bőrt, égeti a szájat és a torkot, ha lenyelik.
Külső hivatkozások
Jegyzetek
- ↑ Rauhut, Michael M. (1969). „Chemiluminescence from concerted peroxide decomposition reactions (science)”. Accounts of Chemical Research 3 (3), 80–87. o. DOI:10.1021/ar50015a003.
- ↑ Wilson, Elizabeth (1999. augusztus 22.). „What's that stuff? Light Sticks” (reprint). Chemical & Engineering News 77 (3), 65. o. DOI:10.1021/cen-v077n003.p065.
- ↑ Chandross, Edwin A. (1963). „A new chemiluminescent system”. Tetrahedron Letters 4 (12), 761–765. o. DOI:10.1016/S0040-4039(01)90712-9.
- ↑ Rood, S. A.: Chapter 4 Post-Legislation Cases. Government Laboratory Technology Transfer: Process and Impact Assessment (Doctoral Dissertation). . (Hozzáférés: 2020. szeptember 23.)
- ↑ Steve Givens. „The great glow stick controversy (Forum Section)”, Student Life, 2005. július 27.
- ↑ (Patent 3,774,022)
- ↑ (Patent 3,764,796)
- ↑ (Patent 3,819,925)
- ↑ (Patent 3,933,118)
- ↑ (Patent 4,064,428)
- ↑ Davies, D (1998). „Diver location devices”. Journal of the South Pacific Underwater Medicine Society 28 (3). . (Hozzáférés ideje: 2021. július 3.)
- ↑ What Is Glowsticking?. Glowsticking.com, 2009. szeptember 19. . (Hozzáférés: 2012. december 21.)
- ↑ Jai Glow! PCD vs. Team Ef Em El. YouTube, 2011. február 21. (Hozzáférés: 2012. december 21.)
- ↑ Largest glowstick. guinnessworldrecords.com. (Hozzáférés: 2020. május 15.)
- ↑ a b c d Kuntzleman, Thomas Scott (2012. június 12.). „The Chemistry of Lightsticks: Demonstrations To Illustrate Chemical Processes”. Journal of Chemical Education 89 (7), 910–916. o. DOI:10.1021/ed200328d. ISSN 0021-9584.
- ↑ Data. www.bnl.gov. (Hozzáférés: 2019. december 15.)
- ↑ Info. www.dtic.mil. . (Hozzáférés: 2019. december 15.)
- ↑ Chemical lighting device – American Cyanamid Company. Freepatentsonline.com, 1981. február 19. (Hozzáférés: 2012. december 21.)
- ↑ a b Kuntzleman, Thomas S. (2009). „Glowmatography”. Journal of Chemical Education 86 (1), 64. o. DOI:10.1021/ed086p64.
- ↑ Chemistry Connections: The Chemical Basis of Everyday Phenomena. Academic Press, 139. o. (2003. április 10.). ISBN 9780124001510 „infrared lightstick.”
- ↑ a b c d Chemiluminescent Compositions And Methods Of Making And Using Thereof – Patent Application. Faqs.org, 2008. december 18. (Hozzáférés: 2012. december 21.)
- ↑ SCAFO Online Articles. scafo.org . . (Hozzáférés: 2021. július 4.)
- ↑ Debutyl Phthalate. PubChem
- ↑ Everything there is to know about glowsticks {{||}}.... glowsticks.co.uk
Fordítás
- Ez a szócikk részben vagy egészben a Glow stick című angol Wikipédia-szócikk fordításán alapul. Az eredeti cikk szerkesztőit annak laptörténete sorolja fel. Ez a jelzés csupán a megfogalmazás eredetét jelzi, nem szolgál a cikkben szereplő információk forrásmegjelöléseként.
A lap szövege Creative Commons Nevezd meg! – Így add tovább! 3.0 licenc alatt van; egyes esetekben más módon is felhasználható. Részletekért lásd a felhasználási feltételeket.
Acetilén
Auer-égő
Ballasztok (világítástechnika)
Banklámpa
Budapest közvilágítása
Davy-lámpa
Disszugáz
Edison-menet
Elektronikus előtét
Fémhalogénlámpa
Fémhalogén autófényszóró lámpa
Fénycső
Fénycsatorna
Fényforrás
Fényhasznosítás
Fénysűrűség
A lap szövege Creative Commons Nevezd meg! – Így add tovább! 3.0 licenc alatt van; egyes esetekben más módon is felhasználható. Részletekért lásd a felhasználási feltételeket.